
| 元素代号 | A | B | D | E | G | I | J | K |
| 化合价 | -1 | -2 | +4 -4 | -1 | +5 -3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | 常温下B元素的单质能与K单质反应 | |
| B. | A、I、J的离子半径由大到小顺序是A>J>I | |
| C. | G元素的单质存在同素异形体 | |
| D. | J在DB2中燃烧生成B元素的单质 |
分析 短周期元素,A、E有-1价,A原子半径小于E,可推知A为F、E为Cl;B有-2价,且A的原子半径与B相差不大,则B为O;D有-4、+4价,原子半径与O原子相差不大,可推知D为C元素;G元素有-3、+5价,处于ⅤA族,原子半径大于C原子,应处于第三周期,则G为P元素;I、J、K的化合价分别为+3、+2、+1,分别处于Ⅲ族A、ⅡA族、ⅠA族,原子半径依次增大,且都大于P原子半径,应处于第三周期,可推知I为Al、J为Mg、K为Na,以此解答该题.
解答 解:A为F,B为O,D为C、E为Cl,G为P;I为Al,J为Mg,K为Na,
A.常温下钠与氧气反应生成氧化钠,故A正确;
B.A、I、J分别为F、Al、Mg,它们的离子核外电子层数相等,离子半径大小顺序为:F->Mg2+>Al3+,故B正确;
C.G为P,对应的同素异形体有红磷、白磷等,故C正确;
D.镁在二氧化碳中燃烧生成氧化镁和碳,故D错误.
故选D.
点评 本题考查了原子结构与元素周期律的关系,为高考常见题型,题目难度中等,正确推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 含有大量Fe3+的溶液中:Na+、Fe2+、Br-、SO42- | |
| B. | 1.0 mol/L KMnO4的溶液中:H+、Na+、Cl-、SO42- | |
| C. | 能与铝反应放出H2的溶液中:K+、Mg2+、SO42-、NO3- | |
| D. | 水电离的c(H+)和C(OH-)之积为l×l0-20mol2•L-2的溶液中:Na+、K+、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④①⑧⑦⑤⑥ | B. | ②③④①⑧⑦⑥⑤ | C. | ②①③④⑧⑦⑥⑤ | D. | ②③④⑧①⑦⑥⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用萃取的方法,并选用酒精作萃取剂 | |
| B. | 萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一烧杯中 | |
| D. | 从分液漏斗中分离出的就是纯净的碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
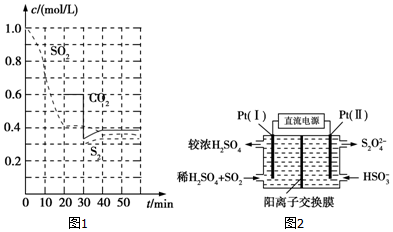
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
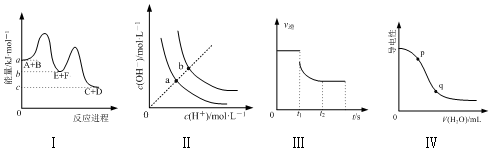
| A. | 图Ⅰ表示反应A+B═C+D的△H=(a-c) kJ•mol-1 | |
| B. | 图Ⅱ表示不同温度下水溶液中H+和OH-的浓度变化曲线,图中a点对应温度高于b点 | |
| C. | 图Ⅲ表示N2+3H2?2NH3的v逆随时间变化曲线,由图知t1时刻可能减小了容器内的压强 | |
| D. | 图Ⅳ表示向醋酸稀溶液中加水时溶液的导电性变化,图中p点pH大于q点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Fe2+、NO3-、SO42- | ||
| C. | K+、Cu2+、NH4+、Cl- | D. | Na+、K+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中正确的是AC
化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中正确的是AC查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com