
假设有一个分子只含有H、N、B其,中HNB=211,它的分子量为80.4,且发现它是非极性分子,抗磁性分子。
(1)此分子有两种可能构型A和B,其中A比B要稳定。请画出它们的结构式,并说明为什么A比B要稳定?
(2)说明A和B分子中化学键的类型;
(3)说明A和B分子为什么是非极性抗磁性分子;
(4)标明A分子中成键骨架原子的形式电荷,并简述理由。
(1)A: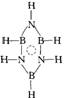 ; B:
; B: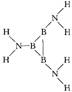
从立体几何的角度看,A式为六元环结构,比B式三元环结构稳定,三元环的张力太大;从纯化学的角度看:A式中的N、B均以sp2杂化轨道成键;在A中,3个N原子的pz轨道上3对孤对电子与3个B原子的空pz轨道形成6中心、6电子的离域π键,而B式却不能形成离域π键。所以A式比B式稳定。
(2)A:B、N sp2杂化,一个∏![]() ;B:B、N sp3杂化
;B:B、N sp3杂化
(3)在成键情况下,上面的两个式子中B、N都没有成单电子,所以都是抗磁性分子。
(4)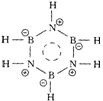
由于A式中的离域π键的形成是N原子将孤对电子提供给B原子(B原子是缺电子原子),综合考虑,N原子因而少电子,因此N原子显示正电荷,B原子显示负电荷。


 阅读快车系列答案
阅读快车系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com