
| A. | 放电时,电池的负极质量减轻 | |
| B. | 放电时,正极周围的pH升高 | |
| C. | 充电时,电池中硫酸的浓度不断减小 | |
| D. | 充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
分析 A.铅蓄电池放电时,负极反应式为Pb+SO42--2e-=PbSO4;
B.放电时,正极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O;
C.充电时,电池反应式为2PbSO4+2H2O=Pb+PbO2+2H2SO4;
D.充电时,阳极反应式为正极反应式的逆反应.
解答 解:A.铅蓄电池放电时,负极反应式为Pb+SO42--2e-=PbSO4,硫酸铅是固体,所以放电时负极质量增加,故A错误;
B.放电时,正极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,氢离子参加反应,所以溶液的pH升高,故B正确;
C.充电时,电池反应式为2PbSO4+2H2O=Pb+PbO2+2H2SO4,该反应中有硫酸生成,所以硫酸的浓度增大,故C错误;
D.充电时,阳极反应式为正极反应式的逆反应,所以阳极反应式为PbSO4-2e-+2H2O═PbO2+SO42-+4H+,故D错误;
故选B.
点评 本题考查原电池和电解池原理,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,正负极的反应与阳极、阴极的反应的逆反应,题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
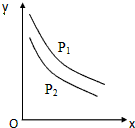 反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 增加L平衡右移 | ||
| C. | a>b | D. | a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4、PH3、H2S、HCl | B. | HF、HCl、HBr、HI | ||
| C. | H2Se、H2S、HCl、HF | D. | NH3、PH3、AsH3、HF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期 IA族 | B. | 第二周期 VIIA族 | C. | 第三周期 IA族 | D. | 第三周期 VIIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可用作食品干燥剂 | |
| B. | 蚕丝、人造丝充分水解后均可得倒氨基酸 | |
| C. | 海水提溴过程中有氧化还原反应发生 | |
| D. | 燃料的脱硫、脱氮都是减少酸雨产生的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀Fe(NO3)2和NaBr混合溶液加入少量稀盐酸:6Br-+8H++2NO${\;}_{3}^{-}$═3Br2+2NO↑+4H2O | |
| B. | 往NH4Al(SO4)2溶液中滴加Ba(OH)2溶液加热,刚好使NH4+全部转化为NH3:NH4++Al3++SO42-+Ba2+4OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Al(OH)3↓+BaSO4+H2O | |
| C. | 碳酸钠溶液呈碱性:CO32-+2H2O?H2CO3+2OH- | |
| D. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com