
分析 (1)涉及的反应有:氧化钠与水反应生成氢氧化钠、钠与水反应生成氢氧化钠和氢气,据此写出反应的化学方程式;
(2)反应生成氢气的质量为0.2g,根据反应2Na+2H2O=2NaOH+H2↑计算出该钠块中金属钠的质量;
(3)该钠块中氧化钠的质量为:m(Na2O)=17.0g-m(Na);
(4)氧化钠的质量为12.4g,则被氧化成氧化钠的金属钠的质量=m(Na2O)×$\frac{46}{62}$;
(5)反应后所得溶液中为NaOH,根据钠元素守恒可知生成NaOH的物质的量为:n(NaOH)=n(Na)+2n(Na2O),然后根据c=$\frac{n}{V}$计算出所得溶液溶质物质的量浓度.
解答 解:(1)涉及的反应有:氧化钠与水反应生成氢氧化钠:H2O+Na2O=2NaOH,钠与水反应生成氢氧化钠和氢气:2Na+2H2O=2NaOH+H2↑,
故答案为:H2O+Na2O=2NaOH;2Na+2H2O=2NaOH+H2↑;
(2)反应生成氢气的质量为0.2g,则:
2Na+2H2O=2NaOH+H2↑
46 2
m(Na) 0.2g
钠块中钠的质量为:m(Na)=$\frac{46×0.2g}{2}$=4.6g,
故答案为:4.6g;
(3)该钠块中氧化钠的质量为:m(Na2O)=17.0g-4.6g=12.4g,
故答案为:12.4g;
(4)氧化钠的质量为12.4g,则被氧化成氧化钠的金属钠的质量=12.4g×$\frac{46}{62}$=9.2g,
故答案为:9.2g;
(5)反应后所得溶液中为NaOH,根据钠元素守恒可知生成NaOH的物质的量为:n(NaOH)=n(Na)+2n(Na2O)=$\frac{4.6g}{23g/mol}$+$\frac{12.4g}{62g/mol}$×2=0.6mol,
所以所得溶液溶质物质的量浓度为:c(NaOH)=$\frac{0.6mol}{0.05L}$=12mol/L,
故答案为:12mol/L.
点评 本题考查化学方程式的计算,题目难度中等,明确反应物和生成物的质量关系为解答关键,解题格式要规范完整,注意区分被氧化的钠和氧化钠的质量,试题侧重考查学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
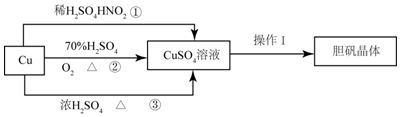
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的实验装置如下:实验中可能用到的数据如表:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的实验装置如下:实验中可能用到的数据如表:| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl- | |
| B. | 当5a=4b时,发生的离子反应为SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl- | |
| C. | 当a≤b≤$\frac{3}{2}$a时,反应中转移电子的物质的量n(e-)为amol≤n(e-)≤3amol | |
| D. | 当a<b<$\frac{3}{2}$a时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素在不同化合物中的化合价均不同 | |
| B. | 金属一定具有良好的导电性、导热性和延展性 | |
| C. | 金属单质在化学反应中化合价一定升高,作还原剂 | |
| D. | 常温下,所有金属都能与酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
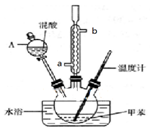 某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):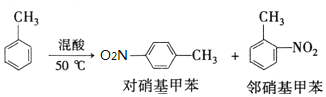
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
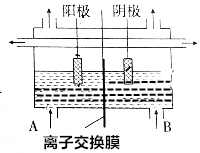 工业上电解饱和食盐水的方法之一是将两个电极室用离子交换膜隔开(如图所示),其目的是防止H2与Cl2混合发生爆炸,防止Cl2与NaOH反应生成NaClO,使NaOH不纯,阳极室(A处)加入饱和食盐水,阴极室(B极)加入水或稀氢氧化钠溶液,离子交换膜只许Na+离子通过.
工业上电解饱和食盐水的方法之一是将两个电极室用离子交换膜隔开(如图所示),其目的是防止H2与Cl2混合发生爆炸,防止Cl2与NaOH反应生成NaClO,使NaOH不纯,阳极室(A处)加入饱和食盐水,阴极室(B极)加入水或稀氢氧化钠溶液,离子交换膜只许Na+离子通过.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com