
����Ŀ����ѧ�ҷ��ֶ�ұ�����е�⾫���ᴿ�ɽ��ߴ����Ʊ��ɱ�����ص���װ����ͼ��ʾ����Cu-Si�Ͻ�����Դ����950����������Һ���ν��е�⾫���� ����˵����ȷ����
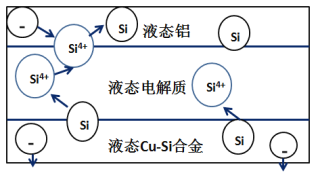
A.������Һ̬Cu-Si�Ͻ�����������Һ̬���缫
B.����Һ���ε�������ʹ�����ܹ����������������
C.�ڸ�Һ��������Cu������Si��������Si4+������Cu2+����ԭ
D.Һ̬���缫�븺����������Ϊ���ص�����
���𰸡�AD
��������
��ͼ��֪��װ��Ϊ���أ�Si4����Һ̬���缫�õ���ת����Si�����Һ̬���缫Ϊ���������ӵ�Դ������Cu��Si�Ͻ����ڵ缫Ϊ���������Դ��������������Һ�����ڵ����г䵱����ʣ����Թ����������ƶ����������ⷴӦ�������߹����Ч�ʣ��ݴ˷�����
A. ��������������Һ̬��Ϊ���������ӵ�Դ��������������Һ̬����Һ̬Cu��Si�Ͻ�Ϊ������������Һ̬Cu��Si�Ͻ�������A����ȷ��
B. ����װ��ͼ������Һ������û�е���ͨ��������Һ���ε������ǿ�����Ч�������ⷴӦ�������ʹ���ʹ��Ч����Һ̬���缫�ϳ�����B�����
C. ��ͼ��֪�����ص�������Siʧ����ת��Si4����������ӦSi4���õ���ת��ΪSi�����Si������Cu��������C�����
D. ��������������Һ̬���缫Ϊ���������ӵ�Դ������D����ȷ��
��ѡAD��


 �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д� ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£������Ϊ2L�ĺ����ܱ������У�ijһ��Ӧ��X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ������
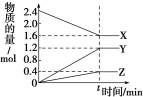
��������ȷ����
A����Ӧ�Ļ�ѧ����ʽΪ2X = 3Y + Z
B��tʱ�������淴Ӧ�����ټ������У���Ӧ�ﵽ��ѧƽ��
C����t=4����0��t��X�Ļ�ѧ��Ӧ����Ϊ0.1 molL��1min��1
D���¶ȡ�������䣬tʱ�̳���1 mol Heʹѹǿ���������淴Ӧ���ʶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����֤ľ̿�ɱ�ŨH2SO4������CO2��ѡ����ͼ��ʾ����(�ں�����)��װ��ʵ��װ�ã�

��1���簴������������������������װ�õ���ȷ˳����(����ӿ���ĸ)��
�� �� �� �� �� ��
��2�������ҡ���Ӧ��������ʵ������ű����Ѽ����CO2?
���� ____ ������ ______ ��
��3����������KMnO4��Һ�������� ��
��4��д�����з�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊm g��ͭ˿���ձ�ڣ������������������У�ʹͭ˿��죬����������Ϊm����
A.H2SO4B.C2H5OHC.ϡHNO3D.NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п�ǵ������������Ľ�������������������ͭ�����ִ���ҵ�ж��ڵ�ص������в���ĥ��Ĺ��ף�����������п����Ϊԭ���Ʊ�����п�Ĺ�ҵ���̡�
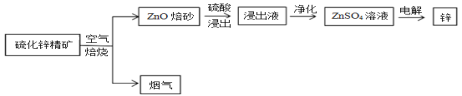
��1������Һ������пΪ���������� Fe3+��Fe2+��A13+��Cl-�����ʣ���Ӱ��п�ĵ�⣬�����ȥ�������������£�
�������������£���H2O2��Fe2+������Fe3+�����ӷ���ʽΪ___��
�ڽ�����Һ��pH����Ϊ5.5���ң�ʹ Fe3+��A13+�γɳ�������ȥ����ѡ�õ�����Լ�Ϊ___������ĸ��
A��NaOH B��NH3��H2O C��Zn(OH)2 D��H2SO4
����Ag2SO4�ɳ�ȥCl-��������Ӧ�����ӷ���ʽΪ______��
�ܵ�����������п�ĵ缫��ӦʽΪ___��
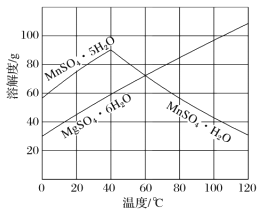
�������е�SO2�������̿�(��Ҫ�ɷ�MnO2�����ʽ���Ԫ��Fe��Al��Mg��)������Һ��Ӧ�Ʊ�MnSO4��H2O��
��2����֪��Ksp[Al(OH)3] =1��10��33��Ksp[Fe(OH)3] =3��10-39��pH =7.1ʱMn(OH)2��ʼ�����������£���ȥMnSO4��Һ�е�Fe3����Al3��(��ʹ��Ũ��С��1��10��6mol��L��1)���������ҺpH��ΧΪ___��
��3����ͼ���Կ�������MnSO4��MgSO4�����Һ�нᾧMnSO4��H2O���壬����ƽᾧ�¶ȷ�ΧΪ___��
��4��п�̼��Ե�ص��ܷ�ӦʽΪ��Zn��2MnO2��2H2O=2MnO(OH)��Zn(OH)2��������ӦʽΪ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ��Ksp��AgCl��=1.77��10��10��Ksp��Ag2CrO4��=2.0��10��12������֪AgCl�ܽ�ȱ�Ag2CrO4���ܽ�ȴ�
B. ����ˮ��ʱ��������̼������Һ���ݣ��������ܽ�
C. ��̼�ᱵ�����м���ϡ���ᣬ��������ת��������֪���ᱵ��Ksp��̼�ᱵ�Ĵ�
D. AgCl��10 mL 0.1 mol/L��KCl��Һ���ܽ����������10 mL0.05mol/L��AgNO3��Һ�ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڷŵ�ͳ��ʱ�ֱ���ԭ��غ͵��ص����ã�ij��طֱ��ڷŵ�ͳ��ʱ�����ķ�Ӧ��Fe��NiO2��2H2O![]() Fe(OH)2��Ni(OH)2�����жԸõ�ص��жϴ�����ǣ� ��
Fe(OH)2��Ni(OH)2�����жԸõ�ص��жϴ�����ǣ� ��
A. �ŵ�ʱ��Fe�Ǹ�����NiO2������
B. �ŵ�ʱ�������Һ�е������������������ƶ�
C. ���ʱ�����ϵĵ缫��ӦʽΪ��Fe(OH)2��2e����Fe��2OH-
D. ���صĵ缫���������Ե������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��WΪԭ��������������Ķ�����Ԫ�أ�Y��WΪͬһ����Ԫ����Wԭ�ӵ���������������Yԭ�ӵĺ���������������γɵ�һ�ֻ�����ṹ��ͼ��ʾ������������ȷ����
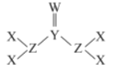
A.ԭ�Ӱ뾶:W>Z>Y>X
B.�û������и�Ԫ�ص�ԭ������������8���ӽṹ
C.X��Y�γɵĶ�Ԫ�����ﳣ����һ��Ϊ��̬
D.X��Y��Z��W���γ�ԭ�Ӹ�����8��1��2��3�Ļ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������İ���ͭ����([Cu(NH3)4]SO4��H2O)������ɱ�����ýȾ�����ڼ��Զ�ͭ��Ҳ���������Һ����Ҫ�ɷ֣��ڹ�ҵ����;�㷺�������¸���������ˮ���������Ҵ������ѣ��ڿ����в��ȶ�������ʱ�����ֽ⡣ij��ѧ��ȤС����Cu�ۡ�3mol/L�����ᡢŨ��ˮ��10% NaOH��Һ��95%���Ҵ���Һ��0.500 mol/Lϡ���ᡢ0.500 mol/L��NaOH��Һ���ϳ������İ���ͭ���岢�ⶨ�䴿�ȡ�
I.CuSO4��Һ���Ʊ�
�ٳ�ȡ4gͭ�ۣ���A����������10���Ӳ����Ͻ��裬������ȴ��
�����������м���30mL 3mol/L�����ᣬ��A�й��������������У����Ȳ����Ͻ��衣
�۳��ȹ��˵���ɫ��Һ��
(1)A����������Ϊ_____________��
(2)ijͬѧ��ʵ������1.5g��ͭ��ʣ�࣬��ͬѧ���Ƶõ�CuSO4��Һ������һ�������м���Ũ�����о�Ĥ���֣���ȴ�����ľ����к��а�ɫ��ĩ���Խ�����ԭ��_____��
II.������Ʊ����������Ʊ���CuSO4��Һ����ͼ��ʾ���в���
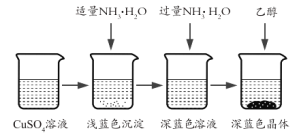
(3)��֪dz��ɫ�����ijɷ�ΪCu2(OH)2SO4����д�����ɴ˳��������ӷ�Ӧ����ʽ___________��
(4)��������ʱ���ü����Ҵ��ķ�����������Ũ���ᾧ��ԭ����_______________��
III.�������IJⶨ����ȷ��ȡmg���壬������ˮ�ܽ⣬ע����ͼ��ʾ������ƿ�У�Ȼ����μ���VmL10%NaOH��Һ��ͨ��ˮ����������ƷҺ�еİ�ȫ����������������ˮ��ϴ�����ڱڣ���V1mLClmol/L���������Һ��ȫ���ա�ȡ�½���ƿ����C2mol/L NaOH����Һ�ζ���ʣ��HCl(ѡ�ü�����ָʾ��)�����յ�ʱ����V2mLNaOH��Һ��
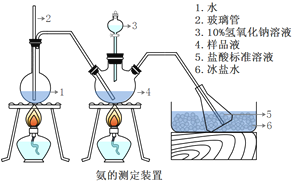
(5)������2������_________________����Ʒ�а������������ı���ʽ_______��
(6)����ʵ���������ʹ�������ⶨ���ƫ�͵�ԭ����______________��
A.�ζ�ʱδ��NaOH����Һ��ϴ�ζ���
B.����ʱ���ζ�ǰƽ�ӣ��ζ�����
C.�ζ�������ѡ�÷�̪��ָʾ��
D.ȡ�½���ƿǰ��δ������ˮ��ϴ�������ƿ�еĵ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com