
| A、1 mol/LAlCl3溶液,含有Al3+的数目为NA |
| B、标准状况下,22.4LCCl4中分子数目为NA |
| C、0.1mol Fe与过量的稀硫酸充分反应,转移的电子数为0.3 NA |
| D、O2和O3组成的48g混合气体中含有3 NA个氧原子 |
| m |
| M |
| 48g |
| 16g/mol |


科目:高中化学 来源: 题型:
| A、铝单质与NaOH溶液反应:2Al+2OH-=2AlO2-+3H2↑ |
| B、醋酸溶液与NaHCO3溶液反应:H++HCO3-=CO2↑+H2O |
| C、SO2通入溴水中:SO2+Br2+H2O=SO42-+2Br-+2H+ |
| D、铁溶于过量稀硝酸中:Fe+4H++NO3-=Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20 g |
| B、25 g |
| C、30 g |
| D、35 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、澄清石灰水跟盐酸反应:H++OH-=H2O |
| C、硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| D、氯化铁溶液跟铜反应:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8mol |
| B、2.6mol |
| C、2.4mol |
| D、0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
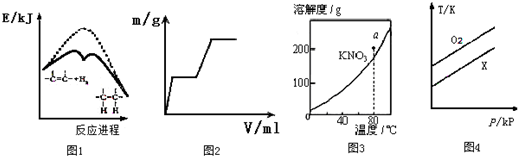
| A、图1说明烯烃与H2的加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
| B、向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系有可能是图2 |
| C、图3表示KNO3的溶解度曲线,图中a点所示的溶液在80℃时不可能存在 |
| D、在体积相同的两个密闭容器中,分别充入等质量的O2和X气体,由图4可确定X可能是CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ |
| B、碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- |
| C、冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O |
| D、稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用SO2漂白品红溶液,加热溶液又恢复红色 |
| B、用带玻璃塞的玻璃试剂瓶盛装NaOH溶液 |
| C、用食醋清洗暖瓶中的水垢 |
| D、用铁制或铝制容器运输浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | M | N | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 1.02 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +6 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -2 | -3 | -2 | |
| A、气态氢化物的稳定性:N>Y |
| B、元素X和Q形成的化合物中不可能含有共价键 |
| C、M(OH)2的碱性比XOH的碱性强 |
| D、X、Z、R的最高价氧化物对应的水化物之间可两两相互反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com