
分析 前四周期元素X、Y、Z、W核电荷数依次增加,Y 原子的M层p轨道有3个未成对电子,则外围电子排布为3s23p3,故Y为P元素;Z与Y同周期,且在该周期中电负性最大,则Z为Cl元素;W原子的L层电子数与最外层电子数之比为4:1,最外层电子数为2,其d轨道中的电子数与最外层电子数之比为5:2,d轨道数目为5,外围电子排布为3d54s2,故W为Mn元素,则X、Y、Z、W四种元素的核电荷数之和为58,则X核电荷数为58-15-17-25=1,故X为H元素,据此解答.
解答 解:前四周期元素X、Y、Z、W核电荷数依次增加,Y 原子的M层p轨道有3个未成对电子,则外围电子排布为3s23p3,故Y为P元素;Z与Y同周期,且在该周期中电负性最大,则Z为Cl元素;W原子的L层电子数与最外层电子数之比为4:1,最外层电子数为2,其d轨道中的电子数与最外层电子数之比为5:2,d轨道数目为5,外围电子排布为3d54s2,故W为Mn元素,则X、Y、Z、W四种元素的核电荷数之和为58,则X核电荷数为58-15-17-25=1,故X为H元素,
(1)由上述分析可知,X的元素符号为:H,Z为Cl元素,在元素周期表中的位置:第三周期第ⅦA族,
故答案为:H;三;ⅦA;
(2)Y与X形成共价化合物A为PH3,Z与X形成共价化合物B为HCl,由于非金属性P<Cl,故氢化物还原性较强的是:PH3,
故答案为:PH3;
(3)由于由于非金属性P<Cl,所以磷酸的酸性小于高氯酸,
故答案为:HClO4;
(4)12.4g单质P4的物质的量为0.1mol,0.3molO2在一定条件下恰好完全反应生成0.1mol化合物P4O6,在P4O6分子中,每个分子中有12个P-O键,含有的σ键数目为012mol,
故答案为:12mol;
(5)含W(Mn)元素的最高化合价的含氧酸根离子是MnO4-,MnO4-离子与FeSO4溶液反应的离子方程式:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,故答案为:MnO4-;MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
点评 本题主要考查了元素周期表、元素周期律、分子结构、氧化还原反应、离子的检验等知识,中等难度,解题的关键是元素推断,答题时注意审题,第(4)问,P4O6的结构为易错点.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:多选题
| A. | Y可能为气态 | B. | Y一定为固态或液态 | ||
| C. | Z可能为气态 | D. | Z一定为固态或液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质与足量的H2加成后,只能生成一种物质 | |
| B. | 该物质既是CH2═CH2的同系物,又是CH≡CH的同系物 | |
| C. | 该物质既能使酸性KMnO4溶液褪色,又能使溴水褪色 | |
| D. | 该物质经加成,加聚后产物是氯丁橡胶(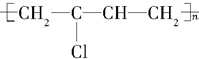 )的主要成分 )的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
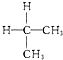 与
与 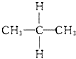
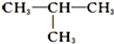
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:6:1 | B. | 6:3:1 | C. | 3:3:1 | D. | 9:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验步骤 |
| ① | 将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
| ② | 向新制得的Na 2S溶液中滴加新制的氯水 |
| ③ | 将一小块金属钠放入滴有酚酞溶液的冷水中 |
| ④ | 将镁条投入稀盐酸中 |
| ⑤ | 将铝条投入稀盐酸中 |
| ⑥ | 向AlCl 3溶液中滴加NaOH溶液至过量 |
| 实验序号 | 实验步骤(略) | 实验现象 | 化学方程式 |
| ① | |||
| ② | |||
| ③ | |||
| ④ | |||
| ⑤ | |||
| ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
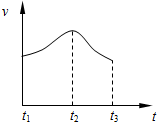 把除去氧化膜的镁条投入到盛有稀HCl的试管中,发现氢气发生的速率变化情况如图所示.
把除去氧化膜的镁条投入到盛有稀HCl的试管中,发现氢气发生的速率变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:正戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>H2O>苯 | |
| C. | 同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷 | |
| D. | 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
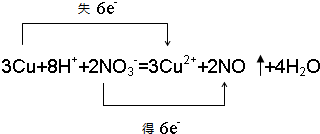 ,在这反应中该强酸展现酸性,氧化性.
,在这反应中该强酸展现酸性,氧化性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com