BD
试题分析:在BeCl
2分子中,Be位于元素周期表第2周期ⅡA族,其原子核外最外层电子数为2,加上共用的两对电子其最外层电子数才为4。这样,虽然Cl原子满足了最外层8电子结构,但Be原子却远未达到8电子结构;磷原子核外最外层电子数为5,它与氯原子形成共价键时,构成PCl
3分子中的磷原子、氯原子最外层都是8电子结构。若构成PCl
5分子,磷原子最外层已是10电子结构,所以B项是本题的一个答案,而C项不符合题述要求;N
2分子因共用三对电子
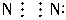
,使两个N原子最外层都满足8电子结构,故D项也是本题的一个答案,因此答案选BD。
考点:考查最外层8电子结构的判断
点评:该题是高考中的常见题型,属于中等难度的试题。本题还可从另一角度求解。若分子中所有原子最外层均满足8电子结构,则分子中各原子的最外层电子数之和应为8×分子中原子总数-2×共价键总数。即若要满足题目要求,BeCl
2分子中各原子的最外层电子数之和应为8×3-2×2=20,而实际为16,缺少电子,不能满足所有原子最外层都是8电子结构。同理,PCl
3、PCl
5、N
2分子中最外层电子数之和应分别为26、38、10,而实际分别为26、40、10,显然,PCl
5分子中有多余电子,也不能满足题目要求。

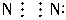 ,使两个N原子最外层都满足8电子结构,故D项也是本题的一个答案,因此答案选BD。
,使两个N原子最外层都满足8电子结构,故D项也是本题的一个答案,因此答案选BD。 
