
 ;R2Q2与X2Q反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;R2Q2与X2Q反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑. 分析 X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,则X为H元素.X与R的最外层电子数相等,二者原子序数相差大于2,故R为Na,可知Z、Q处于第二周期,Z的内层电子数是最外层电子数的一半,Z的原子最外层电子数为4,故Z为碳元素;U的最高化合价和最低化合物的代数和为6,则U为Cl,R和Q可形原子数之比为1:1和2:1的两种化合物,则Q为O元素,R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应,可推知T为Al.
(1)T为Al,元素在期表中的位置是第三周期ⅢA族,由上述元素中的四种元素形成的既含有离子键又含有共价键的化学物为碳酸氢钠、醋酸钠、四羟基合铝酸钠等;
(2)同周期自左而右原子半径减小,所有元素中H原子半径最小;
(3)T、U两元素最高价氧化物对应的水化物分别为Al(OH)3、HClO4,二者发生中和反应;
(4)物理性质不能比较金属性强弱,金属性强弱与失去电子数目多少无关,与失去电子难易程度有关,可以根据金属与水或酸反应难易、剧烈程度以及最高价氧化物的水化物的碱性强弱比较;
(5)R2Q2为Na2O2,由钠离子与氧离子构成,Na2O2与H2O反应生成氢氧化钠与氧气.
解答 解:X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,则X为H元素.X与R的最外层电子数相等,二者原子序数相差大于2,故R为Na,可知Z、Q处于第二周期,Z的内层电子数是最外层电子数的一半,Z的原子最外层电子数为4,故Z为碳元素;U的最高化合价和最低化合物的代数和为6,则U为Cl,R和Q可形原子数之比为1:1和2:1的两种化合物,则Q为O元素,R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应,可推知T为Al.
(1)T为Al,元素在期表中的位置是第三周期ⅢA族,由上述元素中的四种元素形成的既含有离子键又含有共价键的化学物为碳酸氢钠、醋酸钠、四羟基合铝酸钠等,
故答案为:第三周期ⅢA族;碳酸氢钠、醋酸钠、四羟基合铝酸钠等;
(2)同周期自左而右原子半径减小,所有元素中H原子半径最小,故原子半径:H<O<C,
故答案为:H<O<C;
(3)T、U两元素最高价氧化物对应的水化物分别为Al(OH)3、HClO4,反应的化学方程式为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O,强酸,可溶性盐拆,故离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)a.单质的熔点属于物理性质,不能判断金属性强弱,故a错误;
b.金属性强弱与失去电子数目多少无关,与失去电子难易程度有关,故b错误;
c.金属性越强,单质与水反应越剧烈,故c正确;
d.金属性越强,最高价氧化物的水化物的碱性越强,故d正确;
故选:cd;
(5)R2Q2为Na2O2,电子式为 ,Na2O2与H2O反应生成氢氧化钠与氧气,故化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
,Na2O2与H2O反应生成氢氧化钠与氧气,故化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为: ;2Na2O2+2H2O=4NaOH+O2↑.
;2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查结构性质位置关系综合运用,熟练掌握基础知识并灵活运用,注意金属性、非金属性强弱比较实验事实,要注意金属氢化物有关问题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应 | |
| C. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 | |
| D. | 双氧水、高锰酸钾溶液可以完全杀死埃博拉病毒,其消毒原理与漂白粉消毒的原理相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成纤维、光导纤维都属于有机高分子材料 | |
| B. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| C. | 天津港爆炸案对剧毒的氰化钠(NaCN)喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| D. | 利用加热的方法杀死人体内感染的埃博拉病毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
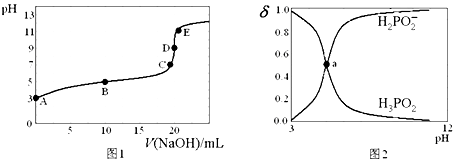
| A. | H3PO2的电离方程式为H3PO2?H2PO2-+H+ Ka≈10-5 | |
| B. | B点时,溶液中存在关系:2c(H+)+c(H2PO2-)═2c(OH-)+c(H3PO2) | |
| C. | C点时,溶液中存在关系:c(Na+)+c(H+)═c(H2PO2-)+c(OH-) | |
| D. | D点时,溶液中微粒浓度大小关系:c(Na+)>c(H2PO2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应,一定是吸热反应 | |
| B. | 1mol酸与碱恰好中和时所放出的热量叫中和热 | |
| C. | 化学反应中的能量变化都表现为热量的变化 | |
| D. | 化学反应中的能量变化,主要是由化学键的变化引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA | |
| B. | 56gN2与CO混合物中原子总数是4NA | |
| C. | 标准状况下,44.8LNO与22.4LO2反应后的分子数是2NA | |
| D. | 常温下,1LpH=l的H2SO4溶液中的H+为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
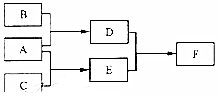 X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期,下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物,下列分析正确的是( )
X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期,下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物,下列分析正确的是( )| A. | 离子半径:Y>Z | B. | Z的含氧酸均为强酸 | ||
| C. | 与Y同周期氰化物中D最稳定 | D. | F含离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
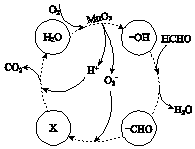 MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:| 离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
| 开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
| 完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com