
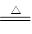 CuSO4��SO2����2H2O
CuSO4��SO2����2H2O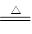 CuSO4��SO2����2H2O��
CuSO4��SO2����2H2O��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ��ʵ�鷽�� | Ԥ���ʵ������ | ���� |
| | | ����____���� |
| | ����____���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��MnO2+4HCl(Ũ) MnCl2+Cl2��+2H2O��ԭ����ǿ������HCl(Ũ)>MnCl2 MnCl2+Cl2��+2H2O��ԭ����ǿ������HCl(Ũ)>MnCl2 |
| B��H2S + CuSO4 =" CuS��+" H2SO4������ǿ������H2S>H2SO4 |
| C��2KClO3+I2=2KIO3+Cl2�ǽ�������ǿ������I>Cl |
| D��NaAlO2 + NaHCO3 + H2O = Al(OH)3 ��+ Na2CO3���������ѣ�Al(OH)3>HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2FeCl2��Cl2��2FeCl3 |
| B��Zn��Ag2O��H2O��Zn(OH)2��2Ag |
| C��HCl��NaOH��NaCl��H2O |
| D��2H2��O2��2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������Ϊ����� | B�������ȥ���� |
| C��˫��ˮ���� | D��SO2��ΪһЩֽ�ŵ�Ư�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ԭ��Cr3+> Fe2+> SO2 | B��������Cr2O72-> SO2> Fe3+ |
| C��������Ӧ��Fe2(SO4)3������ԭ�� | D��Cr2O72-�ܽ�SO2������SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��F2 + H2O (����O2��HF) | B��Na + H2O |
| C��NaH + H2O������H2��NaOH�� | D��Na2O2 + H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com