(2012?福建)酸浸法制取硫酸铜的流程示意图如下
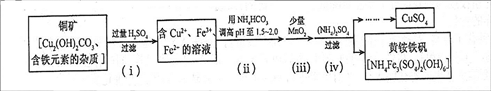
①步骤(i)中Cu
2(OH)
2CO
3 发生反应的化学方程式为
Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O
Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O
.
②步骤(ii)所加试剂起调节pH 作用的离子是
HCO3-
HCO3-
(填离子符号).
③在步骤(iii)发生的反应中,1mol MnO
2转移2mol 电子,该反应的离子方程式为
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
.
④步骤(iv)除去杂质的化学方程式可表示为:3Fe
3++NH
4++2SO
42-+6H
2O=NH
4Fe
3 (SO
4)
2(OH)
6+6H
+过滤后母液的pH=2.0,c (Fe
3+)=a mol?L
-1,c ( NH
4+)=b mol?L
-1,c ( SO
42-)=d mol?L
-1,该反应的平衡常数K=
(用含a、b、d 的代数式表示).



