
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和 Cu(NO3)2,在所得溶液中加入l.0mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
科目:高中化学 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:选择题
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。
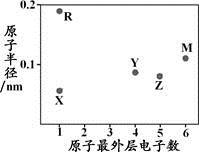
下列说法不正确的是
A. 简单阳离子半径:X< R
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. X与Y可以形成正四面体结构的分子
查看答案和解析>>
科目:高中化学 来源:2017届湖南湖南省长沙市高三月考试卷三化学试卷(解析版) 题型:选择题
具有对称结构的姜黄素有抗氧化、保肝护肝、抑制肿瘤生长等功能。它的一种合成路线如图所示:
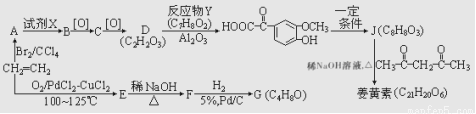
已知:①E、G能发生银镜反应;
②R—CHO+R'—CH2—CHO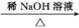
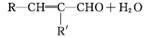 (R、R'表示烃基或氢)。
(R、R'表示烃基或氢)。
③
请回答下列问题:
(1)G的名称是 ;D中所含官能团的名称是 。
(2) A生成B的反应类型是 。
(3)据最新报道,乙烯与双氧水在催化剂作用下反应生成B,产率较高。写出该反应的化学方程式: 。
(4)姜黄素的结构简式为 。
(5)在J的同分异构体中,同时满足下列条件的同分异构体有 种。
A.既能发生水解反应,又能发生银镜反应;
B.遇氯化铁溶液发生显色反应。
(6)参照上述流程,以苯乙烯为原料,设计路线制备某药物中间体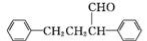 : 。
: 。
查看答案和解析>>
科目:高中化学 来源:2017届湖南湖南省长沙市高三月考试卷三化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用的叙述都正确的是
A.明矾溶液具有强氧化性,可用作净水剂
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀
D.常温下,铝能被浓硝酸钝化,可用铝制槽车运送浓硝酸
查看答案和解析>>
科目:高中化学 来源:2017届河北辛集中学高三上理综测试三化学试卷(解析版) 题型:推断题
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5个,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问題:
(1)以上八种元素中非金厲所形成的最简单气态氢化物稳定性最弱的是_________(填化学式),E、F、H 所形成的简单离子的半径由大到小的顺序为_________(用离子符号表示)
(2)一定条件下,A的单质气体与C的单质气体充分反应生成W气体,W的结构式_____。由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为_____。固体化合物E2D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为________________。
(3)G是非金厲元素,其单质在电子工业中有重要应用,请写出G的最髙价氧化物与B的单貭在高温下发生置换反应的化学反应方程式____________________。
(4)10L的密闭容器中,通入2mol的HD2气体和1molD2的气体单质,一定条件下反应后生成HD3气体,当反应达到平衡时,单质D的浓度为0.01mol·L-1,同时放出约177KJ的热量,则平衡时HD2的转化率为____________;该反应的热化学方程式____________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:填空题
从含铜废料(如:覆铜板、印刷线路板及铅冰铜等)中提取铜,既可提高资源的利用率又可减少重金属污染。
(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回收精铜,阳极上发生的电极反应为 。
(2)废印刷线路板中的铜常用含盐酸的FeCl3溶液或H2O2-HCl- NaCl混合溶液浸取回收。
①用FeCl3溶液浸取铜时发生反应的离子方程式为 ;若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀,产生红褐色沉淀的原因是 。
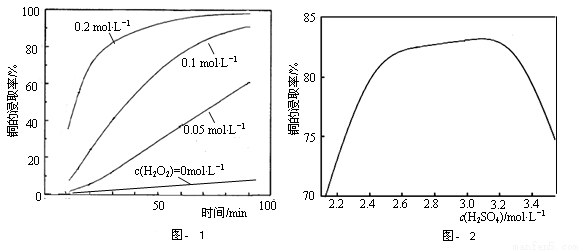
②将粉碎后的废印刷线路板放入三口烧瓶中,分别加入由0.3mol·L-1盐酸、0.5mol·L-1NaCl及不同浓度的H2O2组成的混合溶液,在温度、搅拌速率及固液比等均相同时,铜的浸取率随H2O2的浓度和时间的变化如图-1所示。当c(H2O2)= 0 mol·L-1时,也有少量的铜被浸出,其原因是 。
③用H2O2-HCl- NaCl混合溶液浸取时,其浸取过程包括:
(Ⅰ)Cu+H2O2+2H+=Cu2++2H2O
(Ⅱ)Cu2++Cu 2Cu+
2Cu+
(Ⅲ)Cu++nCl- CuCln(n-1)-
CuCln(n-1)-
(Ⅳ)2CuCln(n-1)-+2H++H2O2=2Cu2++2H2O+2nCl-
其他条件相同时,增大下列离子浓度可以加速Cu从废电路板中浸出的是 (填序号)。
a.Na+ b.Cu2+ c.Cl- d.OH-
(3)铅冰铜(PbS、Cu2S及FeS的混合物)可用HCl-H2O2混合溶液浸取。
①Cu2S被HCl-H2O2混合溶液浸取得到硫酸铜和氯化铜溶液的化学方程式为 。
②若由H2SO4代替HCl-H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图-2所示。当H2SO4浓度大于3.1mol·L-1时,硫酸浓度越大,铜的浸取率反而越小,其原因可能是 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如右图所示。下列说法正确的是

A. Y、Z、W的简单离子的电子层结构相同
B. 原子半径:r(X)<r(Y)<r(Z)<r(W)
C. 简单氢化物的稳定性:X>Y
D. Y与Z两种元素形成的化合物一定只含离子键
查看答案和解析>>
科目:高中化学 来源:2017届江苏省徐州、宿迁、连云港、淮安四市高三11月模拟化学卷(解析版) 题型:填空题
FeCl3可用作印刷电路铜板腐蚀剂和外伤止血剂等
(1)若要溶解电路板上3.2g的铜,则至少需要1 mol·L-1 FeCl3溶液的体积为 mL。
(2)检验腐蚀电路铜板后的溶液中是否存在Fe3+的试剂是 。
(3)腐蚀电路铜板后的溶液中铜元素含量的测定:
取20.00mL腐蚀电路铜板后的溶液于碘量瓶中,先加足量NaF(发生的反应为Fe3++6F-=[FeF6]3-),再加足量的10%KI溶液,摇匀。塞上碘量瓶瓶塞,置于暗处5min,充分反应后(有CuI沉淀生成),加几滴淀粉溶液,用0.1000 mol·L?1Na2S2O3标准溶液滴定到终点时,共消耗20.00mL标准液。测定过程中有关物质的转化关系如下:
若测定过程中碘量瓶敞口置于暗处5min,会导致测定结果 (填:“偏高”、“偏低”、“无影响”)。
计算该腐蚀液中铜元素的含量(用g·L?1表示),写出计算过程。
查看答案和解析>>
科目:高中化学 来源:2017届云南曲靖市高三上学期第三次月考化学试卷(解析版) 题型:选择题
取三份不同组成镁铝混合物分别加入1mol/L的盐酸,待混合完全溶解后,往溶液中加入1mol/L的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如下所示.下列说法中错误的是

A.图I中a的取值范围为0≤a<≤50
B.图I中 的最大值为2.5
的最大值为2.5
C.图II中a的取值范围为80<a<96.7
D.图III中a的取值范围为75<a<80
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com