
盐酸或硫酸和氢氧化钠溶液的中和反应没有明显的现象。某学习兴趣小组的同学为了证明氢氧化钠溶液与盐酸或硫酸发生了反应,从中和反应的热效应出发,设计了下面几种实验方案。请回答有关问题。
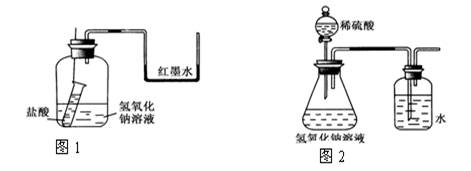
(1)方案一:如图1装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上。开始时使右端U形管两端红墨水相平。实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内氢氧化钠溶液混合,此时观察到的现象是_________ ,原因是___________。
(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生。如果氢氧化钠溶液与盐酸混合前后有温度的变化,则证明发生了化学反应。该小组同学将不同浓度的氢氧化钠溶液和盐酸各10 mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:
|
编号 |
盐酸 |
氢氧化钠 |
△t/℃ |
|
1 |
0.1 mol·L-1 |
0.05 mol·L-1 |
3.5 |
|
2 |
0.1 mol·L-1 |
0.1 mol·L-1 |
x |
|
3 |
0.2 mol·L-1 |
0.2 mol·L-1 |
14 |
则x=____________。
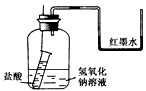
(3)方案三:该小组还设计了如图2示装置来证明氢氧化钠溶液确实与稀硫酸发生了反应。他们认为若洗气瓶中导管口有气泡冒出,则说明该反应放出热量,从而证明发生了反应。
①实验时,打开分液漏斗活塞,发现导管流出液体不畅,原因可能是______________
②从原理上讲,该实验设计的不合理之处为__________________________________。
请你在此实验装置的基础上提出修改方案__________________________________。
(1)方案一:U形管内液面左边下降、右边升高 ;
盐酸和氢氧化钠发生中和反应放出热量,使瓶内气体温度升高,压强增大
(2)7
(3)①没打开分液漏斗上部塞子
②稀硫酸具有一定的体积,冒出气泡的原因可能是加入稀硫酸的体积引起的;
分液漏斗上口和锥形瓶之间连接一导管
【解析】(1)由于盐酸和氢氧化钠发生中和反应放出热量,使瓶内气体温度升高,压强增大,所以U形管内液面左边下降、右边升高。
(2)根据表中数据可知,实验2中生成水的物质的量是实验1中的2倍,实验溶液升高的温度也应该是2倍,即温度差是7℃。
(3)①要保证液体顺利流下,则有关保证内外压强相等,因此可能的原因是没有分液漏斗上部塞子。
②原因稀硫酸具有一定的体积,冒出气泡的原因也可能是加入稀硫酸的体积引起的。所
以改进的方法就是在分液漏斗上口和锥形瓶之间连接一导管,使容器内气体体积不变的。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸和浓盐酸长期暴露在空气中浓度均降低 | B、氯化铵中混有少量杂质碘可以用加热法进行提纯 | C、氯化亚铁和亚硫酸钠长期暴露在空气中均会变质 | D、可用二硫化碳或热的氢氧化钠溶液清洗附着在试管壁上的硫 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南安阳一中高二月考(奥数班)化学试卷(带解析) 题型:实验题
盐酸或硫酸和氢氧化钠溶液的中和反应没有明显的现象。某学习兴趣小组的同学为了证明氢氧化钠溶液与盐酸或硫酸发生了反应,从中和反应的热效应出发,设计了下面几种实验方案。请回答有关问题。
(1)方案一:如图1装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上。开始时使右端U形管两端红墨水相平。实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内氢氧化钠溶液混合,此时观察到的现象是_________ ,原因是___________。
(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生。如果氢氧化钠溶液与盐酸混合前后有温度的变化,则证明发生了化学反应。该小组同学将不同浓度的氢氧化钠溶液和盐酸各10 mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:
| 编号 | 盐酸 | 氢氧化钠 | △t/℃ |
| 1 | 0.1 mol·L-1 | 0.05 mol·L-1 | 3.5 |
| 2 | 0.1 mol·L-1 | 0.1 mol·L-1 | x |
| 3 | 0.2 mol·L-1 | 0.2 mol·L-1 | 14 |
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com