
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是![]()
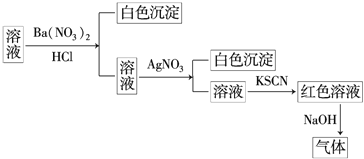
A.原溶液中一定含有![]() B.原溶液中一定含有
B.原溶液中一定含有![]()
C.原溶液中一定含有![]() D.原溶液中一定含有
D.原溶液中一定含有![]()
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M为四种短周期元素。X、Y、Z是原子数依次递增的同周期元素,X与Z可形成常见的XZ或XZ2型分子,Y与M形成的气态化合物对氢气的相对密度为8.5。下列判断正确的是( )
A.最高价含氧酸的酸性:X<Y<ZB.X、Y、Z可形成离子化合物
C.M与Z形成的分子中只有一种共价键D.最简气态氢化物的沸点![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A.![]() 的同分异构体中,能与
的同分异构体中,能与![]() 反应生成
反应生成![]() 的有4种
的有4种
B. 该有机物分子中所有碳原子可能在同一平面上
该有机物分子中所有碳原子可能在同一平面上
C.淀粉、纤维素、塑料和氨基酸均属于天然高分子化合物
D.糖类、油脂、蛋白质都是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:
2H2(g)+CO(g)![]() CH3OH(g) ΔH=-90.8kJ/mol。
CH3OH(g) ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K=______,如升高温度,K值将_____(填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是____________.
A、混合气体的密度保持不变 B、甲醇的质量分数保持不变
C、CO的浓度保持不变 D、2v逆(H2)=v正(CH3OH)
(3)在2100C、2400C和2700C三种不同温度、2L恒容密闭容器中研究合成甲醇的规律。
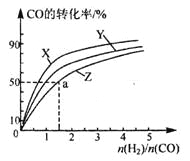
上图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是____________。由起始达到a点所需时间为5min,则H2的反应速率____________mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。

①该电池工作时,正极是_____极(填“a”或 “b”);
②该电池负极反应的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的钙离子、镁离子、硫酸根离子及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
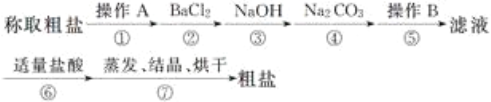
(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)____________________________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是_________________________。
(4)判断氯化钡已过量的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取蒸馏水如图所示:
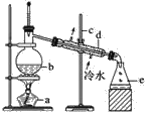
请回答下列问题:
(1)仪器b的名称是___,仪器d的名称是___。
(2)蒸馏水收集在仪器____中。
(3)仪器d的作用是___,冷水进入d仪器的方向如图所示,不能改为“上进下出”的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于工业制备方法与化学方程式均正确的是( )
A.工业上用电解饱和食盐水的方法制取氯气:2NaCl![]() 2Na + Cl2↑
2Na + Cl2↑
B.工业上用乙醇在浓硫酸的作用下制取乙烯: CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
C.工业上用氢气还原四氯化硅制得高纯度的硅:SiCl4+2H2![]() Si+4HCl
Si+4HCl
D.工业以硫黄为原料生产硫酸,沸腾炉中的主要反应: 2S+3O2![]() 2SO3
2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定条件下,下列各组离子一定能大量共存的是
A.滴加甲基橙显红色的溶液中:Na+、Fe2+、C1-、NO![]()
B.0.1mol·L-1FeC13溶液中:NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、NO
、NO![]()
C.0.1mo1·L-1KI溶液中:Na+、K+、ClO-、OH-
D.由水电离的c(H+)=1.0×10-13 mo1·L-1的溶液中:K+、NH![]() 、C1-、HCO
、C1-、HCO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com