
����Ŀ�������к��зḻ�ĵ⣮Ϊ�˴Ӻ�������ȡ�⣬ij�о���ѧϰС����Ʋ�����������ʵ�飺 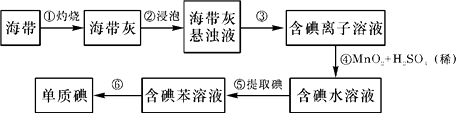
����д���пհף�
��1����������պ���ʱ������Ҫ���ż��⣬����Ҫ�õ���ʵ����������������������ѡ��������������ñ����ĸ��д�ڿհ״�����
A.�ձ�
B.����
C.������
D.������
E.�ƾ���
F.������
��2������۵�ʵ������������������Ŀ���ǴӺ��ⱽ��Һ�з�������ʵ�ͻ��ձ����ò����ʵ����������� ��
��3������ܷ�Ӧ�����ӷ���ʽ�� ��
��4��������У�ijѧ��ѡ���ñ�����ȡ��������� ��
��5�������һ�ּ�����ȡ����ˮ��Һ���Ƿ��е��ʵ�ļ��� ��
���𰸡�
��1��BDE
��2�����ˣ�����
��3��2I��+MnO2+4H+=Mn2++I2+2H2O
��4������ˮ�������ܣ����ڱ��е��ܽ�ȱ���ˮ�д�
��5��ȡ������ȡ����ˮ��Һ���Թ��У����뼸�ε�����Һ���۲��Ƿ������ɫ�����������˵�����е��ʵ⣩
���������⣺��1�����չ�������һ��ʹ�ã��ɣ�������������������Ҫ��������֧��Ȼ��������ż��ϣ����ż�����Ŀռ�žƾ��ƣ����Դ��ǣ�BDE����2��������Ƿ�������Һ�壬��ʵ�����Ϊ���ˣ������Ŀ���ǴӺ��ⱽ��Һ�з�������ʵ�ͻ��ձ��������û��ܵ�����Һ��ķе㲻ͬ�����룬��ʵ�����Ϊ���� ���Դ��ǣ����ˣ�����3�������������������¿ɱ�MnO2���������Դ��ǣ�2I��+MnO2+4H+=Mn2++I2+2H2O����4��������ȡ�Ļ���ԭ�������ܼ��������ܣ���������һ���ܼ��е��ܽ�ȱ�����һ�ִ�Ķ࣬���Դ��ǣ�����ˮ�������ܣ����ڱ��е��ܽ�ȱ���ˮ�д�5���������۱���ɫ�����Դ��ǣ�ȡ������ȡ����ˮ��Һ���Թ��У����뼸�ε�����Һ���۲��Ƿ������ɫ�����������˵�����е��ʵ⣩��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. ��������ƽ�Ϸ���Ƭ��С������һ����ֽ��Ȼ���������Ʒ���ֽƬ�ϳ���
B. �ѳƵõ��������Ʒ���ʢ����������ˮ���ձ��У��ܽ⡢��ȴ���ٰ���Һ��������ƿ
C. ������ˮϴ���ձ���������2��3�Σ�ϴ��ҺҲ��������ƿ
D. �ز�����������ƿ�м�������ˮ�����̶���1��2cmʱ���ý�ͷ�ιܵμӣ�ֱ����Һ��Һ��ǡ����̶�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ�������һ����̼��ԭm g�����������õ�n g������֪�������ԭ������Ϊ16�����������ԭ������Ϊ
A. 21n/(m-n) B. 64n/(3m-3n)
C. (m-n)/32n D. 24n/(m-n)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������֤��H2��g��+I2��g��2HI��g���Ѵ�ƽ��״̬����
A. һ��H��H �����ѵ�ͬʱ������H��I������
B. ���º���ʱ��ijһ������Ũ�Ȳ��ٱ仯
C. ���º���ʱ�����������ɫ���ٱ仯
D. ���¡�ѹǿһ��������ɱ�����������������ܶȲ��ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���˳���������ȷ����
A. ������ۣ�P��S��Cl��Ar B. ���ȶ��ԣ�H2O��HF��HCl
C. ����ǿ����HNO3��H2CO3��H3PO4 D. ��ԭ�� F�� ��Cl����Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2 L��������ijһ��Ӧ��A��B�����ʵ�����ʱ��仯����������ͼ��ʾ����ͼ�����ݷ�������
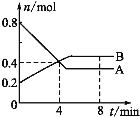
��1����4 minĩʱ��A��B�����ʵ���Ũ��c(A)��������c(B)����0~4 min��A��B�����ʵ���Ũ�ȱ仯����c(A)����������c(B)(�����>����<����=��)��
��2���ӷ�Ӧ��ʼ��4 minʱ��A��ƽ����Ӧ����Ϊ������
��3���÷�Ӧ�Ļ�ѧ����ʽΪ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڵ�����KI��Һ�д�������ƽ�⣺I2(aq)��I��(aq)![]() I
I![]() (aq)����ò�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ��K�����ʾ��
(aq)����ò�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ��K�����ʾ��
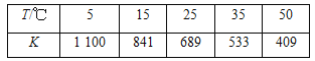
����˵����ȷ����(����)
A. ��ӦI2(aq)��I��(aq)![]() I
I![]() (aq)����H>0
(aq)����H>0
B. �����������䣬�����¶ȣ���Һ��c(I![]() )��С
)��С
C. �÷�Ӧ��ƽ�ⳣ������ʽΪK��![]()
D. 25 ��ʱ������Һ�м�������KI���壬ƽ�ⳣ��K����689
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п�̸ɵ��Ϊʹ��һ�κ�ͱ������ĵ�أ����й�������ȣ���������뻷�����������Σ����ij��ѧ��ȤС����������´����������շϵ���еĸ�����Դ��
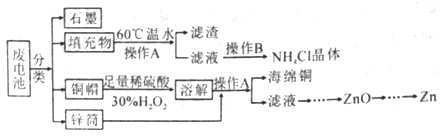
��1����60����ˮ�ܽ�����Ŀ����________��
��2������B������Ϊ_____________��
��3��ͭñ�ܽ�Ļ�ѧ����ʽΪ__________��ͭñ�ܽ���ȫ�ɲ���_____������ȥ��Һ�й�����H2O2��
��4��������к���MnOOH��MnO2�Ȼ�����������м���һ������ϡ�����l0mLϡ���ᣬ�õ�MnSO4��Һ���ռ���896mLCO2(��״����)������ϡ��������ʵ���Ũ����_________��
��5����һ����ˮ���м�������MnSO4��Һ�ͼ���KI��Һ������MnO(OH)2����,�ܷ⾲��,��������ϡH2SO4����MnO(OH)2��I-��ȫ��Ӧ����Mn2+��I2���Ե�����ָʾ������Na2S2O3����Һ�ζ����յ������ô˷������Բⶨˮ���ܽ�����Ũ�����ⶨ���������ʵ�ת����ϵ���£�
![]()
ȡһ�����ij���ˮ��l00.00mL�������������ⶨˮ�����ܽ���������0.0100molL-1 Na2S2O3����Һ13.50mL����ˮ���е��ܽ�����Ũ��Ϊ____mgL-1��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com