
| A.标况下,燃烧1mol S放出的热量为297.23 kJ |
| B.S ( g ) + O2 ( g ) = SO2 ( g ) 放出的热量大于297.23 kJ |
| C.S ( g ) + O2 ( g ) = SO2 ( g )放出的热量小于297.23 kJ |
| D.形成1 mol SO2的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |
科目:高中化学 来源:不详 题型:填空题

 ,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
|
|
|
|
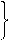 2CO(g)+O2(g) ="==" 2CO2(g)2H2(g)+O2(g) =2H2O(g)
2CO(g)+O2(g) ="==" 2CO2(g)2H2(g)+O2(g) =2H2O(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应必然伴随能量变化 |
| B.25℃,101kPa下,l mol C8H18(辛烷)燃烧生成CO2和液态水时放出5518 kJ热量,其热化学方程式为:C8H18 (l)+12.5O2 (g)=8CO2 (g)+9H2O (l)△H=+5518kJ?mol-1 |
| C.酸和碱的中和反应都是放热反应 |
| D.反应物总能量高于生成物总能量,则该反应一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g) +D(g)过程中的能量变化如图所示,则下列说法正确的是
C(g) +D(g)过程中的能量变化如图所示,则下列说法正确的是
| A.该反应是放热反应 |
| B.反应体系中加入催化剂对反应热有影响 |
| C.当反应达到平衡时,升高温度,A的转化率减小 |
| D.改变压强与加催化剂对反应的影响原因相同,都不会使平衡发生移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 中和热为57.3kJ/mol 。下列热化学方程式正确的是
中和热为57.3kJ/mol 。下列热化学方程式正确的是| A.HNO3(aq)+KOH(aq)=H2O(l) +KNO3(aq)ΔH > -57.3kJ/mol. |
B.HNO3(aq)+NH3 ·H2O(aq)=H2O(l) +KNO3(aq)ΔH <  -57.3kJ/mol. -57.3kJ/mol. |
| C.CH3COOH(aq)+KOH(aq)=H2O(l) + CH3COOK(aq) ΔH< -57.3kJ/mol. |
| D.CH3COOH(aq)+ NH3 ·H2O(aq)=H2O(l) + CH3COONH4(aq) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化反应一定有物质变化,不一定有能量变化 |
| B.化合反应一定是放热反应 |
| C.放热反应不需要加热就一定能发生 |
| D.吸热反应不加热也可能发生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
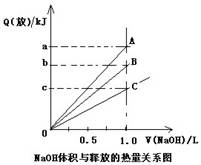
| A.A是稀硝酸与NaOH溶液反应 | B.B是醋酸溶液与NaOH溶液反应 |
| C.b是5.73 | D.C是浓硫酸与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com