
【题目】X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素,Y是地壳中含量最高的元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是( )
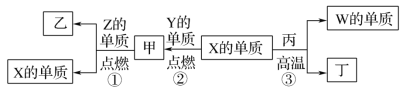
A.反应③为工业制粗硅的原理
B.Z位于元素周期表第三周期ⅡA族
C.4种元素的原子中,Y原子的半径相对最小
D.甲、丙、丁均为酸性氧化物,可以与碱反应得到对应盐
【答案】D
【解析】
由题意Y是地壳中含量最高的元素先推出Y为O元素,X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,可在甲中燃烧生成X的单质,应为镁与二氧化碳的反应,则Z为Mg,甲为CO2,乙为MgO,由此关系可知X为C元素,X、W为同一主族元素,则W为Si,丁为CO,丙为SiO2,以此解答该题。
由以上分析可知X为C、Y为O、Z为Mg、W为Si,甲为CO2,乙为MgO,丙为SiO2,丁为CO;
A.反应③为C与二氧化硅的反应,生成硅和CO,为工业制粗硅的原理,故A正确;
B.Z为镁,位于元素周期表第三周期ⅡA族,故B正确;
C.4种元素的原子中,Mg、Si处于第三周期,C、O处于第二周期,电子层越多,半径越大,C、O处于同周期,从左至右,半径减小,因而O的原子半径最小,故C正确;
D.甲、丙、丁分别为CO2、SiO2、CO,其中CO为不成盐氧化物,故D错误。
答案为D。


科目:高中化学 来源: 题型:
【题目】已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是
A.Q1=2Q2=92.4B.Ql>2Q2C.Q1<2Q2D.Q1=2Q2≠92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Fe与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.向K2CO3溶液中通入过量SO2:CO![]() +2SO2+H2O=CO2+2HSO
+2SO2+H2O=CO2+2HSO![]()
C.在强碱溶液中NaClO与FeCl3反应生成Na2FeO4:3ClO-+2Fe3++5H2O=2 FeO![]() +3Cl-+10H+
+3Cl-+10H+
D.用新制的Cu(OH)2检验乙醛中的醛基:CH3CHO+Cu(OH)2+OH-![]() CH3COO-+Cu+2H2O
CH3COO-+Cu+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小颖同学用如图所示装置研究原电池原理,下列说法错误的是( )
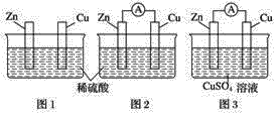
A.若将图1装置的Zn、Cu直接接触,Cu片上能看到气泡产生
B.图2装置中![]() 向Cu片移动
向Cu片移动
C.若将图2中的Zn片改为Mg片,Cu片上产生气泡的速率加快
D.图2与图3中正极生成物的质量比为1:32时,Zn片减轻的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于实验装置的有关说法错误的是( )
A.装置Ⅰ:可以用来验证碳的非金属性比硅强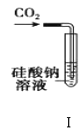
B.装置Ⅱ:可以用来比较Na2CO3和NaHCO3的热稳定性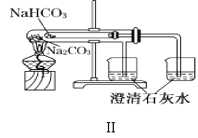
C.装置Ⅲ:先从①口进气收集满二氧化碳,再从②口进气,则可收集NO气体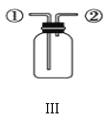
D.装置Ⅳ:可以用于制备Fe(OH)2并能保证相对较长时间观察到白色沉淀Fe(OH)2 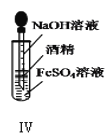
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种实验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条褪色。则D瓶中盛有的溶液是( )

A. 浓硫酸B. 饱和氯化钠溶液C. 浓氢氧化钠溶液D. 氢氧化钙悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行如下反应:N2+3H2![]() 2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
A. v(NH3)=0.02mol/(L·min)
B. v(NH3)=0.01mol/(L·min)
C. v(N2)=0.01mol/(L·min)
D. v(H2)=0.03mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com