
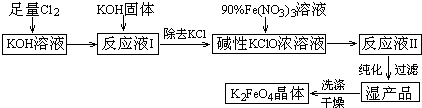
分析 (1)由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,由信息②可知温度较高KOH与Cl2 反应生成的是KClO3;
(2)工业是利用电解饱和食盐水制取氯气;
(3)K2FeO4中铁元素化合价为+6价,价态高;
(4)根据n=$\frac{m}{M}$计算出氢氧化钾的物质的量,溶液质量等于溶质质量与溶剂质量之和,利用V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算氢氧化钾溶液的物质的量浓度;
(5)由工艺流程可知,反应液I中有过量的Cl2反应,生成更多的KClO;
(6)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl.KNO3可用于化肥,炸药等.
解答 解:(1)由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,由信息②可知温度较高KOH与Cl2 反应生成的是KClO3.由信息①可知,在低温下KOH与Cl2 反应生成的是KClO.故选择低温较低,
故答案为:温度较低;
(2)工业是利用电解饱和食盐水制取氯气.反应方程式为:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$ 2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$ 2NaOH+H2↑+Cl2↑;
(3)K2FeO4中铁元素化合价为+6价,价态高,易得电子,表现强氧化性,
故答案为:K2FeO4中铁元素化合价为+6价,易得电子;
(4)61.6g KOH固体的物质的量为$\frac{61.6g}{56g/mol}$=1.1mol,溶液的质量为100mL×1g/mL+61.6g=161.6g,所以溶液的体积为$\frac{161.6g}{1.47×10{\;}^{3}g/L}$=$\frac{161.6}{1470}$L,所以氢氧化钾溶液的物质的量浓度为$\frac{1.1mol}{\frac{161.6}{1470}L}$=10mol/L,
故答案为:10mol/L;
(5)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.
A、与过量的Cl2继续反应,生成更多的KClO,故A正确;
B、由信息②可知温度较高KOH与Cl2 反应生成的是KClO3,不利用KClO生成、浪费原料,故B错误;
C、由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,故C正确;
D、由信息可知,该条件下KClO3 不能转化为KClO,故D错误.
故选:AC;
(6)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl.KNO3可用于化肥,炸药等,
故答案为:KNO3、KCl;KNO3可用于化肥,炸药等.
点评 本题考查学生阅读题目获取信息的能力、对工艺流程的理解与条件的控制、对物质的量浓度理解等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,注意基础知识的掌握.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子式为C6H14含有四个甲基的烃的一氯取代物的异构体数目为5 | |
| B. | 分子式为C5H10异构体数目为5 | |
| C. | 分子式为C4H10O的醇类异构体数目为4 | |
| D. | 分子式为C6H12O2羧酸类异构体数目为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 814.8 | 400.3 | 97.3 |
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 137.7 | 428.8 | 97.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
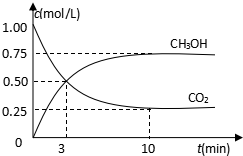 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在485℃时,在体积为1L的密闭容器中,充入1ol CO2和3mol H2,一定条件下发生反应合成甲醇:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在485℃时,在体积为1L的密闭容器中,充入1ol CO2和3mol H2,一定条件下发生反应合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | NaOH | C. | AgNO3 | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com