
| A. | 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷 | |
| B. | 将稀硫酸和无水酒精按3:1的体积比混合加热到170℃制取乙烯 | |
| C. | 将电石和饱和食盐水置于启普发生器中制取乙炔 | |
| D. | 用酸性KMnO4溶液可将己烷和己烯二种无色液体鉴别开来 |
分析 A.氯气和乙烷发生取代反应生成多种氯代烃;
B.乙醇在浓硫酸作催化剂条件下制取乙烯;
C.实验室不能用启普发生器制取乙炔气体;
D.烷烃和酸性高锰酸钾溶液不反应,含有碳碳不饱和键的烃或连接苯环的碳原子上含有H原子的苯的同系物能被酸性高锰酸钾溶液氧化.
解答 解:A.氯气和乙烷发生取代反应生成多种氯代烃,所以不能用氯气和乙烷制取氯乙烷,故A错误;
B.乙醇在浓硫酸作催化剂条件下制取乙烯,稀硫酸不能作该反应的催化剂,故B错误;
C.此反应大量放热,生成的氢氧化钙是糊状物,反应很剧烈,应选用分液漏斗,以便控制水的流速,故实验室不能用启普发生器制取乙炔气体,应用分液漏斗和平底烧瓶,故C错误;
D.烷烃和酸性高锰酸钾溶液不反应,含有碳碳不饱和键的烃或连接苯环的碳原子上含有H原子的苯的同系物能被酸性高锰酸钾溶液氧化,环己烷中不含碳碳不饱和键,不能被酸性高锰酸钾溶液氧化,环己烯中含有碳碳双键,所以能被酸性高锰酸钾溶液氧化,则可以用酸性高锰酸钾溶液鉴别环己烷和环己烯,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、仪器选取、物质鉴别等知识点,明确实验原理、物质性质是解本题关键,注意仪器用途、物质性质方面分析判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向 AlCl3溶液中滴加浓氨水至过量:Al3++4OH-═AlO2-+2H2O | |
| B. | 漂白粉溶液中通入过量SO2:ClOˉ+H2O+SO2═HSO3-+HClO | |
| C. | CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 在澄清石灰水中加入少量小苏打溶液:Ca2++OHˉ+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ①②③⑤⑦ | D. | ④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入反应物,使活化分子的百分数增加,反应速率加快 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小体积)可增加活化分子的百分数使化学反应速率增大 | |
| C. | 升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 活化分子间发生的碰撞为有效碰撞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
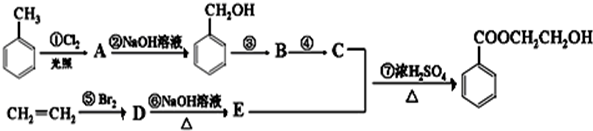
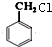 .
. +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl写出第⑥步反应的化学方程式:BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr.
+HCl写出第⑥步反应的化学方程式:BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① | |
| B. | 将0.5 mol/L的Na2CO3溶液与amol/L的NaHCO3溶液等体积混合,c(Na+)<c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,溶液中离子浓度关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 25℃某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
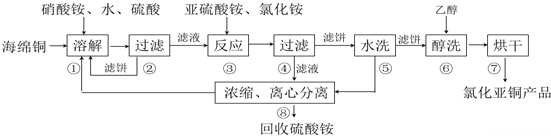
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| B. | 23g Na 与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com