
(14分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
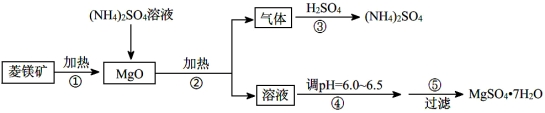
请回答下列问题:
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)对MgSO4·7H2O晶体直接加热 (填“能”或“不能”)得到无水MgSO4固体。
(4)步骤⑤的操作为 。
(5)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为 [25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12]。
(7)药品A是中和胃酸的常用药物,其有效成分是铝和镁的碱式碳酸盐。现进行如下实验确定其化学式:
实验一:取该碱式碳酸盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;
实验二:另取该碱式碳酸盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀。
该药品的化学式为 。
(每空2分,共14分)
(1)2NH4+MgO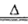 Mg2++2NH3↑+H2O
Mg2++2NH3↑+H2O
(2)抑制Mg2+水解,以便得到较纯的产品
(3)能
(4)蒸发浓缩、冷却结晶
(5)MgCO3+H2O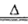 Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
(6)蓝色
(7)Al2Mg6(OH)16CO3·4H2O
【解析】
试题分析:(1)根据流程图可知,硫酸铵与MgO加热产生的气体可与硫酸反应有生成硫酸铵,所以该气体为氨气,所以MgO与铵根离子水解生成的氢离子反应,促进铵根离子的水解,家入围生成氨气,则硫酸铵与MgO在加热条件下反应生成氨气和镁离子、水,离子方程式是2NH4+MgO Mg2++2NH3↑+H2O;
Mg2++2NH3↑+H2O;
(2)得到的溶液为硫酸镁溶液,因为镁离子水解,生成氢氧化镁和硫酸,所以调节溶液的pHpH=6.0~6.5的目的是抑制Mg2+水解,以便得到较纯的产品;
(3)虽然镁离子水解生成氢氧化镁和硫酸,但硫酸是高沸点酸,不易挥发,则水解不会进行彻底,所以加热硫酸镁晶体能得到无水MgSO4固体;
(4)从溶液中得到晶体的操作为蒸发浓缩、冷却结晶,过滤,所以步骤⑤的操作为蒸发浓缩、冷却结晶;
(5)长时间加热MgCO3悬浊液后生成Mg(OH)2,同时有二氧化碳生成,化学方程式是MgCO3+H2O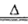 Mg(OH)2+CO2↑;
Mg(OH)2+CO2↑;
(6)25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12,设氢氧化镁的饱和溶液中氢氧根离子的浓度为x,则5.6×10-12=0.5x×x2,x近似为10-4mol/L,氢氧化镁的饱和溶液的pH近似等于10,所以25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为蓝色;
(7)根据实验一可知该碱式碳酸盐3.01g充分灼烧至恒重,生成水和二氧化碳的总质量是1.30g,根据实验二可知,生成的二氧化碳的物质的量是0.112L/22.4L/mol=0.005mol,其质量是0.005mol×44g/mol=0.22g,则水的质量是1.30g-0.22g=1.08g,则水的物质的量是1.08g/18g/mol=0.06mol;根据实验三可知,生成的氢氧化镁的质量是1.74g/mol,则3.01g固体中MgO的物质的量是1.74g/58g/mol=0.03mol,所以氧化铝的质量是(3.01-1.30-0.03mol×40g/mol)g=0.51g,所以Al2O3的物质的量是0.51g/102g/mol=0.005mol,则该药品中Al2O3:MgO:H2O:CO2=0.005:0.03:0.06:0.005=1:6:12:1,所以该药品的化学式是Al2Mg6(OH)16CO3·4H2O。
考点:考查对流程图的分析,基本操作的判断,物质化学式的计算


科目:高中化学 来源:2014-2015学年山东省潍坊市高三12月月考化学试卷(解析版) 题型:选择题
火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2=Cu2S+2FeS+SO2 则下列说法正确的是
A.CuFeS2仅作还原剂,硫元素被氧化
B.每生成1mol Cu2S,有4 mol硫被氧化
C.SO2只是氧化产物,FeS只是还原产物
D.每转移1.2 mol电子,有0.2mol硫被氧化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省新余市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
以0.10mol/L的氢氧化钠溶液滴定某一元弱酸的滴定曲线如图所示。横轴为加入氢氧化钠的体积数,纵轴为溶液的pH。下列正确的是
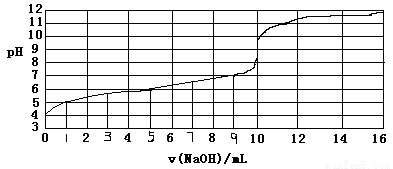
A.此一元弱酸的电离常数(Ka)约为1.0×10-6
B.此弱酸的浓度为1×10-4mol/L
C.此实验最好选用甲基红(变色范围在4.2~6.3)作指示剂
D.此滴定反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
甲 | 乙 | 丙 | |
A | Na | H2O | Cl2 |
B | Al | Fe2O3 | 稀H2SO4 |
C | CH3CH2OH | NaOH溶液 | CH3COOH |
D | Ba(OH)2溶液 | CO2 | Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
2014年诺贝尔化学奖授予超高分辨率荧光显微镜的贡献者。人类借助于这种显微镜可以观察到单个的蛋白质分子。下列有关叙述不正确是

A.蛋白质中含有碳、氢、氧、氮等元素
B.蛋白质属于高分子化合物
C.蛋白质可完全水解生成氨基酸
D.消毒过程中细菌蛋白质发生了盐析
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
对于主族元素R形成化合物的分子式为HROm,其水溶液呈酸性,下列说法中正确的是
A.m越大,其HROm的氧化性越强 B.m越大,其HROm的酸性越强
C.与Zn反应时,只能产生一种气体 D.当m=3时,R一定为ⅤA族
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:实验题
(15分)资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[xMg(OH)2?yMgCO3]
(2)为了确定产物成份(包括产生的气体、白色不溶物及溶液中溶质),进行以下定性实验。请填写表中空白:
实验序号 | 实 验 | 实验现象 | 结 论 |
实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为 ① |
实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量 ② | ③ | 白色不溶物中含有MgCO3 |
实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 ④ 稀溶液 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32-离子 |
(3)为进一步确定实验I中白色不溶物的成分,进行以下定量实验,装置如图所示:
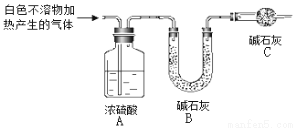
称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
①装置C的作用是 ;
②白色不溶物的化学式为 。
(4)根据以上(2)及(3)的定性定量实验,写出镁与饱和碳酸氢钠溶液反应的化学方程式
__________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
现有常温下的四种溶液(如下表),下列有关叙述中正确的是
① | ② | ③ | ④ | |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |
A.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11
B.将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(Cl-)>c(OH-)>c(H+)
C.分别加水稀释10倍、四种溶液的pH:①>②>③>④
D.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮北市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下图是一种新型的镁电池,因其成本低,电流强度大备受关注。该电池的总反应是:Mg+FeSO4 MgFeSO4在放电过程中a极质量会增加,下列说法正确的是
MgFeSO4在放电过程中a极质量会增加,下列说法正确的是

A.放电时,电子从b极通过电解质流向a极
B.放电时,没转移0.2mol电子,消耗2.4g的Mg
C.电解质是含镁离子的水溶液
D.充电时,b极上的电极反应式为:Mg2++FeSO4+2E=MgFeSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com