
【题目】将地壳中含量较多的四种元素按从多到少的顺序排列,正确的是
A.Si、O、Al、FeB.O、Si、Al、FeC.Al、Fe、O、SiD.Si、Al、O、Fe
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大.A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
(1)b、c、d中第一电离能最大的是(填元素符号),e的价层电子轨道示意图为 .
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键,又含有非极性共价键的化合物是(填化学式,写两种).
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是;酸根呈三角锥结构的酸是 . (填化学式)
(4)c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 . 
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示).该化合物中阴离子为 , 阳离子中存在的化学键类型有;该化合物加热时首先失去的组分是 , 判断理由是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在8NH3+3Cl2 = N2 + 6NH4Cl反应中,有21.3克氯气参加了反应,则被氧化的NH3的质量是( )
A. 13.6克 B. 10.2克 C. 6.8克 D. 3.4克
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定已部分变质的过氧化钠样品的纯度,设计右图所示的实验装置,
图中Q为弹性良好的气球,称取一定量的样品放入其中,按图安装好仪器,打开了漏斗的活塞,将稀硫酸滴入气球中。请填空:
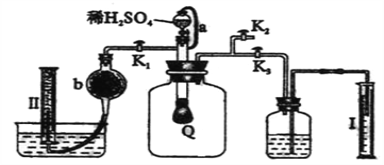
(1)Q内发生化学反应时,生成的气体是__________________。(写化学式)
(2)为了测定反应生成气体的总体积,滴加稀硫酸之前,K1、K2、K3中应当关闭的是______________,应当打开的是_______________。
(3)当上述反应停止,将K1、K2、K3均处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是__________________________________________________。
(4)b中装的固体试剂是_____________,缓缓打开K1的原因是______________________。
(5)实验结束时,量筒I中有x mL水,量筒II中收集到y mL气体(已折算成标准状态),则过氧化钠的纯度的数学表达式是__________________________________(需化成最简表达式。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是一种治疗心血管疾病的药物,它的合成路线如下: 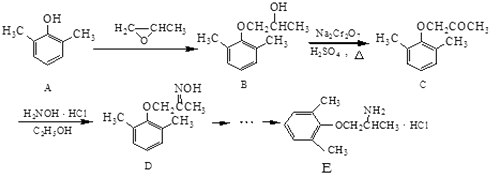
(1)C分子中含氧官能团的名称为 .
(2)由B→C的反应类型为 .
(3)由A制备B的过程中有少量副产物F,它与B互为同分异构体,F的结构简式为 .
(4)写出同时满足下列条件的D的一种同分异构体的结构简式: . ①属于α﹣氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子.
(5)已知乙烯在催化剂作用与氧气反应可以生成环氧乙烷(). 写出以邻甲基苯酚 ( 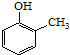 )和乙醇为原料制备
)和乙醇为原料制备  的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
合成路线流程图示例如下:H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液中,离子能够大量共存的是( )
A. H+ Cl- Fe2+ NO3-B. OH- Na+ SO42- HCO3-
C. NH4+ Cl- K+ OH-D. F- Na+ OH- NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②NH4+、③NO3﹣、④K+、⑤CO32﹣、⑥OH﹣分别加入H2O中,基本上不影响水的电离平衡的是( )
A.③④
B.②③⑥
C.①⑥
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中 ![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mLpH=11的NaOH溶液,混合液的pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com