
【题目】某实验小组同学对影响 CuSO4 溶液和浓氨水反应产物的因素进行了如下探究。
(查阅资料)
①Cu(OH)2(s) Cu2+ + 2OH- Ksp = 2.2×10-20;![]() Cu2+ + 4NH3 K = 4.8×10-14
Cu2+ + 4NH3 K = 4.8×10-14
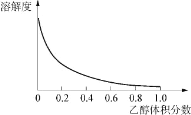
②Cu(NH3)4SO4·H2O 是一种易溶于水、难溶于乙醇的深蓝色固体, 加热分解有氨气放出。Cu(NH3)4SO4·H2O 在乙醇-水混合溶剂中的溶解度如下图所示。
(实验 1)CuSO4 溶液和浓氨水的反应。
序号 | 实验内容 | 实验现象 |
1-1 | 向 2 mL 0.1 mol/L CuSO4(pH=3.2)中逐滴加入 2 mL 1 mol/L 氨水 | 立即出现浅蓝色沉淀,溶液变无色; 随后沉淀逐渐溶解,溶液变为蓝色;最终得到澄清透明的深蓝色溶液 A |
1-2 | 向 2 mL 1 mol/L 氨水中逐滴加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 始终为澄清透明的深蓝色溶液 B |
(1)进一步实验证明,深蓝色溶液 A、B 中均含有![]() ,相应的实验方案为______________________(写出实验操作及现象)。
,相应的实验方案为______________________(写出实验操作及现象)。
(实验 2)探究影响 CuSO4 溶液和浓氨水反应产物的因素。
序号 | 实验内容 | 实验现象 |
2-1 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,溶液颜色变浅 |
2-2 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 1 mol/L NaOH | 有浅蓝色沉淀生成,上层清液接近无色 |
2-3 | 向 2 mL 0.1 mol/L 氨水中逐滴加入2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,上层清液接近无色 |
(2)依据实验 2-1,甲同学认为 Cu2+浓度是影响 CuSO4 溶液和浓氨水反应产物的因素之一。乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,并设计了如下对比实验:
序号 | 实验内容 | 实验现象 |
2-4 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 试剂 a | 无明显现象 |
①用化学用语表示硫酸铜溶液呈酸性的原因:___________________________。
②试剂 a 为 ___________________________。
(3)利用平衡移动原理对实验 2-2 的现象进行解释:____________________________。
(4)实验 2-3 的目的是__________________________。
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有________________________。
【答案】向深蓝色溶液中加入大量乙醇,出现深蓝色沉淀,过滤洗涤沉淀后,将沉淀置于试管中加热,并将湿润的红色石蕊试纸放在试管口,观察到红色的石蕊试纸变蓝 Cu2+ +2H2OCu(OH)2+2H+ c(SO42-)= 0.1 mol/L且pH=3.2的硫酸—硫酸钠混合溶液 存在![]() Cu2+ + 4NH3,当加入氢氧化钠溶液,氢氧根离子和铜离子结合成氢氧化铜浅蓝色沉淀,使平衡向右移动,
Cu2+ + 4NH3,当加入氢氧化钠溶液,氢氧根离子和铜离子结合成氢氧化铜浅蓝色沉淀,使平衡向右移动,![]() 浓度降低,溶液变为无色 与实验 1-2对比,探究其它条件相同的情况下,氨水浓度对反应产物的影响; 铜离子的浓度、溶液的碱性、氨水的浓度(或氨水的浓度、硫酸铜和氨水的相对用量)
浓度降低,溶液变为无色 与实验 1-2对比,探究其它条件相同的情况下,氨水浓度对反应产物的影响; 铜离子的浓度、溶液的碱性、氨水的浓度(或氨水的浓度、硫酸铜和氨水的相对用量)
【解析】
根据控制变量法分析影响 CuSO4 溶液和浓氨水反应产物的因素。
(1)因为Cu(NH3)4SO4·H2O是一种易溶于水、难溶于乙醇的深蓝色固体, 加热分解有氨气放出,所以检验溶液 A、B 中均含有![]() ,向溶液中加入大量乙醇,出现深蓝色沉淀,过滤洗涤沉淀后,将沉淀置于试管中加热,并将湿润的红色石蕊试纸放在试管口,观察到红色的石蕊试纸变蓝;
,向溶液中加入大量乙醇,出现深蓝色沉淀,过滤洗涤沉淀后,将沉淀置于试管中加热,并将湿润的红色石蕊试纸放在试管口,观察到红色的石蕊试纸变蓝;
(2)①硫酸铜是强酸弱碱盐,铜离子水解使溶液显酸性,水解的离子方程式是Cu2++2H2OCu(OH)2+2H+;
②跟据乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,根据控制变量法,应设计一个对比实验,对比在没有Cu2+且c(SO42-)和pH相同的条件下对反应产物的影响,所以可以加入c(SO42-)= 0.1 mol/L且pH=3.2的硫酸—硫酸钠混合溶液,排除酸性溶液的干扰;
(3) ![]() Cu2++ 4NH3是可逆反应,当加入氢氧化钠溶液时,铜离子与氢氧根离子反应生成氢氧化铜沉淀,使铜离子浓度减少,依据勒夏特列原理,平衡向向右移动,
Cu2++ 4NH3是可逆反应,当加入氢氧化钠溶液时,铜离子与氢氧根离子反应生成氢氧化铜沉淀,使铜离子浓度减少,依据勒夏特列原理,平衡向向右移动,![]() 浓度降低,溶液变为无色;
浓度降低,溶液变为无色;
(4)实验 2-3是对比实验,与实验 1-2对比,探究其它条件相同的情况下,氨水浓度对反应产物的影响;
(5)有实验2-1、2-2、2-3可以推测,影响CuSO4 溶液和浓氨水反应产物的因素有铜离子的浓度、溶液的碱性、氨水的浓度(或氨水的浓度、硫酸铜和氨水的相对用量)。


科目:高中化学 来源: 题型:
【题目】标准状况下,某气态烷烃和烯烃(含一个双键)的混合气体2.24 L完全燃烧后,将产生的气体缓慢通过浓硫酸,浓硫酸增重4.05 g,剩余气体通过碱石灰,碱石灰增重6.60 g。另再取2.24 L标准状况下的该混合气体,将它通入过量的溴水中,溴水增重1.05 g。
(1)确定混合气体由哪两种烃组成_______。
(2)计算混合气体中两种烃的体积分数_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是______。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)______。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为______。
②完成NaClO3氧化FeCl2的离子方程式:
___![]() +___Fe2++___=___Cl+___Fe3++__
+___Fe2++___=___Cl+___Fe3++__
(3)FeCl3在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]()
![]() +H+ K2
+H+ K2
![]() +H2O
+H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是__________。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)______。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)______。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是___。
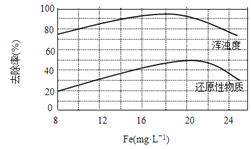
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为_____mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是
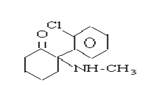
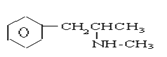
氯胺酮(K粉) 冰毒
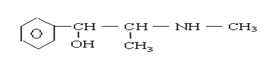
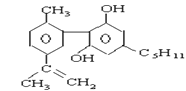
摇头丸 大麻
A.K粉的分子式为C13H16ClNO
B.这四种毒品都属于芳香烃
C.1mol大麻最多可与含4mol Br2的浓溴水发生反应
D.摇头丸不可能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R元素无同位素。21gR2+金属离子内含有22×3.01×1023个中子,取等质量的该元素单质与酸反应,在标准状况下生成11.2LH2。
(1)21g R2+金属阳离子中含有_________mol质子?_________________mol电子?
(2)R是__________元素?写出该元素原子核的组成_______________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种水系锌离子电池总反应式为xZn+Zn1-xMn2O4![]() ZnMn2O4.(0<x<1)。下列说法错误的是( )
ZnMn2O4.(0<x<1)。下列说法错误的是( )
A.充电时,阳极的电极反应式为Zn1-xMn2O4+xZn2++2xe-=ZnMn2O4
B.放电时,Zn2+向正极迁移
C.充放电过程中锌与锰的化合价都发生变化
D.放电时,每转移1mole-正极质量增加32.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为
①C3N3(OH)3![]() 3HNCO
3HNCO
②8HNCO+6NO2![]() 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是( )
A.反应①是氧化还原反应
B.反应②中HNCO是氧化剂
C.反应②中,每转移1 mol电子,消耗NO2 0.25 mol
D.反应②中氧化剂、还原剂的物质的量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活和社会密切相关。下列有关说法不正确的是![]()
A.发展“低碳经济”能够减少对化石能源的依赖
B.明矾溶于水会生成氢氧化铝胶体,故可用明矾作净水剂
C.铁制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀
D.处理含![]() 的废水,常用FeS作沉淀剂,是因为CuS的溶解度比FeS小
的废水,常用FeS作沉淀剂,是因为CuS的溶解度比FeS小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com