
【题目】NA代表阿伏加德罗常数的值。下列说法错误的是
A.常温常压下,62 g P4中所含P—P键数目为2NA
B.23g钠在空气中反应生成Na2O和Na2O2,转移电子数为NA
C.标准状况下,11.2LCO2和SO2混合物中含O原子数目为NA
D.0.1mol氯化铁水解形成的Fe(OH)3胶体粒子数小于0.1 NA
【答案】A
【解析】
A.每1molP4含有6molP—P键,而62 g P4含有![]() mol P4分子,因而62 g P4中所含P—P键数目为6×0.5NA=3NA,A项错误;
mol P4分子,因而62 g P4中所含P—P键数目为6×0.5NA=3NA,A项错误;
B.钠在空气中反应生成Na2O和Na2O2,钠元素化合价从0价变为+1价,易知23gNa为1mol,因而转移电子数为1×1×NA=NA,B项正确;
C.标准状况下,11.2LCO2和SO2混合物中含有气体分子的物质的量为![]() mol,由于CO2和SO2中分子数与氧原子数之比均为1:2,所以O原子数目为0.5×2×NA=NA,C项正确;
mol,由于CO2和SO2中分子数与氧原子数之比均为1:2,所以O原子数目为0.5×2×NA=NA,C项正确;
D. 易知0.1mol氯化铁水解形成的Fe(OH)3粒子数为0.1 NA,但由于Fe(OH)3胶体粒子由若干个Fe(OH)3聚合而成,所以Fe(OH)3胶体粒子数小于0.1 NA,D项正确。
故选A.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中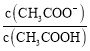 减小
减小
C.醋酸的电离程度增大,c(H+)也增大
D.溶液中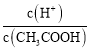 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是

A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】250C时,向20.0mL0.10mol/L氨水中滴入0.10mol/L盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )
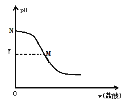
A.本实验应选用的指示剂是甲基橙
B.M点处的溶液中c(NH4+)=c(Cl)>c(H+)=c(OH)
C.N点处的溶液中pH<12
D.M点对应的盐酸体积为20.0mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)具有强氧化性,受热易分解,可作漂白剂、食品消毒剂等。
Ⅰ.亚氯酸钠的制备
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
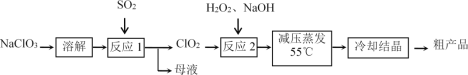
(1)“反应1”中的氧化剂是_____(填化学式,下同),母液中溶质的主要成分是_____。
(2)每有1mol SO2参加反应,理论上可生成ClO2的物质的量为________mol。
(3)如果将SO2换为Na2SO3和稀H2SO4,则“反应1”的离子方程式为________。
(4)“反应2”使用H2O2而不使用其他物质的主要理由是____________________。
Ⅱ.亚氯酸钠的应用
(5)用亚氯酸钠作水处理剂,水中可能残留少量亚氯酸钠,可以加入硫酸亚铁除去残留的亚氯酸盐,硫酸亚铁除可与亚氯酸钠反应外,还可以起到的作用是____________。
(6)实验室可用亚氯酸钠和氯酸钠在酸性条件下反应制备ClO2气体。
①上述反应的离子方程式为____________。
②ClO2也可用于杀菌消毒,其消毒能力是等物质的量Cl2的_______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、镁、铝三种金属分别和同体积同浓度的盐酸反应,同温同压下,产生相同体积的氢气,则参加反应的金属 ( )
A.所失去的电子数相等B.参加反应的金属质量相等
C.参加反应的金属物质的量相同D.铁、镁、铝的质量比为56:24:27
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3ySO3zH2O),为测定某碱式硫酸铁的组成,取5.130g样品溶于足量盐酸中,然后加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体1.600g,该样品的化学式为( )
A.Fe2O32SO37H2OB.4Fe2O310SO325H2O
C.3Fe2O36SO320H2OD.2Fe2O35SO317H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:![]()
反应Ⅱ:![]()
反应Ⅲ:H2O(1)=H2O(g) △H3=+44.0 kJ·mol-1
则反应:![]() __________kJ/mol
__________kJ/mol
(2)将氨气与二氧化碳在有催化剂的反应器中反应![]() ,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:

①a点________(填是或不是)处于平衡状态,T1之后尿素产率下降的原因是___________________________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
③已知该反应的![]() ,
,![]() ,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
![]() ;
;
![]()
①25℃时,向N2H4水溶液中加入H2SO4,欲使![]() ,同时
,同时![]() ,应控制溶液pH范围_____________(用含a、b式子表示)。
,应控制溶液pH范围_____________(用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业排放物可能对环境和人体健康产生危害,必须经过处理才可排放。根据题意回答下列问题。
Ⅰ.处理含SO2、NO的烟气
在323 K温度下,向盛有NaClO2溶液的鼓泡反应器中通入含有SO2和NO的烟气。
(1)写出NaClO2溶液脱硝过程中反应的离子方程式___________________ 。
(2)由实验测得,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)采用NaClO、Ca(ClO) 2替代NaClO2,也能较好的除去SO2。从化学平衡原理分析,Ca(ClO) 2相比NaClO具有的优点是___________________。
Ⅱ.处理含H2S的烟气
生物脱H2S原理为:
H2S(g) + Fe2(SO4)3(aq) = S(s) + 2FeSO4(aq) + H2SO4(aq) ΔH1
4FeSO4(aq) + O2(g) + 2H2SO4(aq) ![]() 2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
(1)反应2H2S(g) + O2 (g) = 2S(s) + 2H2O(l) 的ΔH3=___________________。
(2)若反应温度过高,反应速率下降(如图),其原因是______________。

Ⅲ.处理污水的化学方法有许多,混凝法、氧化还原法、中和法、电解法等。处理含Na2SO4的废水常用三室式电渗析法,原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。

(1)负极反应式为___________________。
(2)当电路中通过1![]() 电子的电量时,会有_________
电子的电量时,会有_________![]() 的O2生成。
的O2生成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com