
 C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )| A. | C60、Si60、N60都属于新型化合物 | |
| B. | C60、Si60、N60分子内共用电子对数目相同 | |
| C. | 由于N-N键能小于N≡N,故N60的稳定性弱于N2 | |
| D. | 由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
分析 A、由一种元素组成的纯净物是单质,由两种或两种以上不同元素所组成的纯净物是化合物;
B、1个碳原子、硅原子形成4对共用电子对,1个氮原子形成3对共用电子对;
C、键能越小,化学键越不稳定;
D、组成和结构相似的分子晶体,相对分子质量越大,晶体的熔点越高.
解答 解:A、C60、Si60、N60都是只有一种元素组成的纯净物,属于单质,故A错误;
B、1个碳原子、硅原子形成4对共用电子对,1个氮原子形成3对共用电子对,C60、Si60分子内共用电子对数目相同,与N60分子内共用电子对数目不同,故B错误;
C、N-N键能小于N≡N,键能越小,化学键越不稳定,故N60的稳定性弱于N2,故C正确;
D、C60和Si60属于分子晶体,相对分子质量越大,分子晶体的熔点越高,与键能无关,故D错误,
故选C.
点评 本题考查了晶体类型与熔点的关系,注意晶体类型的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 铜片是正极 | B. | 锌片质量逐渐减少 | ||
| C. | 电子从锌片经溶液流向铜片 | D. | 正极的电极反应式:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
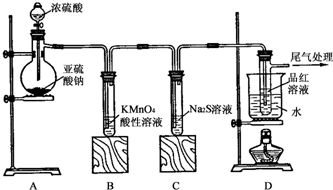
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

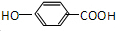 .
. .
. .
.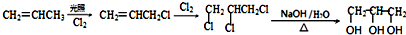 . (已知:CH2=CHCH3$→_{Cl_{2}}^{光照}$CH2=CHCH2Cl)
. (已知:CH2=CHCH3$→_{Cl_{2}}^{光照}$CH2=CHCH2Cl)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
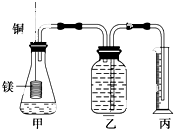 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 | |
| C. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用,迅速混合后测出初始温度,用环形玻璃搅拌棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 | |
| D. | 将含有少量氯化钾的硝酸钾放入烧杯中,加水溶解并加热、搅拌,当溶液表面出现一层晶膜时停止加热,冷却结晶,过滤即可得到大量硝酸钾晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com