
已知H2(g)+I2(g)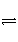
 2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度
B.甲中加入0.1 mol He,乙不变
C.甲降低温度,乙不变
D.甲增加0.1 mol H2,乙增加0.1 mol I2
科目:高中化学 来源: 题型:
A、B、C、D为四种可溶性盐,它们的阳离子分别是Ba2+、Ag+、Na+、
Cu2+中的某一种,阴离子分别是NO 、SO
、SO 、Cl-、CO
、Cl-、CO 中的某一种。(离子在物
中的某一种。(离子在物
质中不能重复出现)
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入足量盐酸,B盐的溶液有沉淀生成,D盐的溶液有
无色无味的气体逸出。
(1)根据①②实验事实可推断它们的化学式为A________,B________。
(2)写出足量盐酸与D反应的离子方程式 __________________________。
(3)写出C与Ba(OH)2溶液反应的离子方程式:
_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)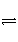
 3C(g),若反应开始
3C(g),若反应开始
时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A.1 mol B和3 mol C
B.2 mol A、1mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C
D.2 mol A、3mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
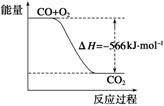
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
某氮肥厂氨氮废水中的氮元素多以NH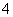 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:

(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用:
________________________________________________________________________。
②用化学平衡原理解释通空气的目的:
________________________________________________________________________。
(2)过程Ⅱ:在微生物作用的条件下,NH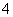 经过两步反应被氧化成NO
经过两步反应被氧化成NO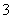 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
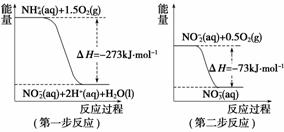
① 第一步反应是________反应(选填“放热”或“吸热”),判断依据是
________________________________________________________________________。
②1 mol NH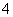 (aq)全部氧化成NO
(aq)全部氧化成NO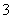 (aq)的热化学方程式是
(aq)的热化学方程式是
________________________________________________________________________。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH,转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于放热反应H2+Cl2 2HCl,下列说法中,正确的是( )
2HCl,下列说法中,正确的是( )
A.产物所具有的总能量高于反应物所具有的总能量
B.反应物所具有的总能量高于产物所具有的总能量
C.断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量
D.该反应中,化学能只转变为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
焦炭是工业生产中的重要还原剂和燃料,活性炭用于生活和实验室中通过吸附作用除去有害气体或有毒物质。它们的化学成分都可以看成是碳单质。
(1)红热的焦炭投入浓硝酸中,写出反应的化学方程式 ;
(2)将一定条件下的高锰酸钾溶液与活性炭混合,可发生如下反应(未配平) MnO4-+ C+ H2O—— MnO2+ ① +CO32-,则 ① 处应该填入的微粒化学式为 ;
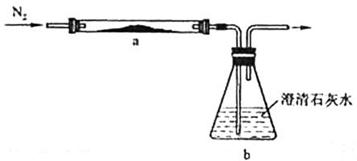 (3)PbO俗称密陀僧或铅黄,将黄色粉末状PbO和足量活性炭充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按图连接仪器。实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却。此时,管中的熔融物凝固成银白色金属。
(3)PbO俗称密陀僧或铅黄,将黄色粉末状PbO和足量活性炭充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按图连接仪器。实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却。此时,管中的熔融物凝固成银白色金属。
写出反应管a中发生的所有反应的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com