
A、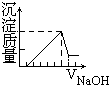 |
B、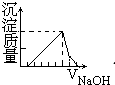 |
C、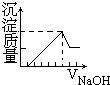 |
D、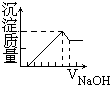 |
| ||
|
| ||
|


科目:高中化学 来源: 题型:
| A、6.4 | B、4.8 |
| C、3.2 | D、2.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往氢氧化铁胶体中逐滴加入稀盐酸先出现沉淀后沉淀溶解 |
| B、在含2 mol的氢氧化铁的胶体中含有氢氧化铁胶粒数为2NA |
| C、滤纸可将氢氧化铁胶体中的分散质与分散剂分离 |
| D、氢氧化铁胶体带正电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式盐 | B、可溶盐 | C、钠盐 | D、酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
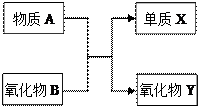 A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示,试写出符合下列条件的化学方程式:
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示,试写出符合下列条件的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
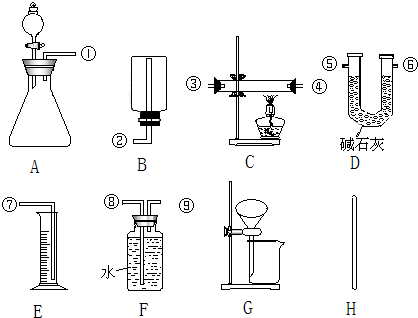
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com