
| A、升高温度 |
| B、改用含有少量杂质铜的锌 |
| C、改用98%的浓硫酸 |
| D、加水 |


科目:高中化学 来源: 题型:
A、由CH2=CHCOOCH3合成的聚合物为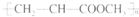 |
| B、溴乙烷与NaOH乙醇溶液共热生成乙烯 |
| C、装饰材料中的甲醛和芳香烃会造成居室污染 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
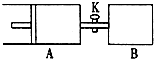 如图,容器A左侧是可平行移动的活塞.关闭活塞K,向A中充入1molX和1molY,向B中充入2molX和2molY,起始时A、B的体积都等于aL.在温度相同、外界压强相同和催化剂存在的条件下,使两容器各自发生反应:X(g)+Y(g)?Z(g)+2W(g).达平衡时,A的体积为1.2aL.下列说法正确的是( )
如图,容器A左侧是可平行移动的活塞.关闭活塞K,向A中充入1molX和1molY,向B中充入2molX和2molY,起始时A、B的体积都等于aL.在温度相同、外界压强相同和催化剂存在的条件下,使两容器各自发生反应:X(g)+Y(g)?Z(g)+2W(g).达平衡时,A的体积为1.2aL.下列说法正确的是( )| A、反应速率:V(B)<V(A) |
| B、A容器中X转化率为20% |
| C、平衡时的压强:P(B)=2P(A) |
| D、若打开K,则达到新的化学平衡时,A的体积为2.6aL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用物质A表示该反应的平均反应速率为0.2mol?L-1?s-1 |
| B、平衡时物质A和B的转化率相等 |
| C、平衡时物质B的浓度为0.2mol/L |
| D、若将容积体积压缩为1L,B的平衡浓度变为原来的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若平衡时,甲、乙两容器中A的物质的量不相等,则x=3 |
| B、平衡时,甲、乙两容器中A、B的物质的量之比不相等 |
| C、平衡时甲中A的体积分数为40% |
| D、若平衡时两容器中的压强不相等,则两容器中压强之比为8:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
 ;△H1
;△H1查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 7 |
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.5mol/L |
| B、0.75mol/L |
| C、0.5mol/L |
| D、0.25mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com