
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 2 | 3 | 0 |
分析 化学平衡常数K=$\frac{生成物平衡浓度系数次幂之积}{反应物平衡浓度系数次幂之积}$;反应前后气体的总物质的量不变,体系压强升高,说明温度升高.
解答 解:在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)?3C(g)+2D(s)反应,其化学平衡常数K=$\frac{{c}^{3}(C)}{{c}^{2}(A)×c(B)}$;反应前后气体的总物质的量不变,已知反应后体系压强升高,而气体的物质的量不变,说明温度升高,即该反应为放热反应,升高温度平衡向逆方向移动,则平衡常数减小;
故答案为:$\frac{{c}^{3}(C)}{{c}^{2}(A)×c(B)}$;减小.
点评 本田考查了化学平衡常数的表达式、影响平衡常数的因素,题目难度不大,注意把握平衡常数表达式的书写方法、固体不能写入平衡常数表达式.


科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6、-2 | +5、-3 | -2 | +3 |
| A. | 离子半径大小:R3+<X+<M2- | |
| B. | Y与M组成的化合物是光化学烟雾的原因之一 | |
| C. | 将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生 | |
| D. | R的单质是铝热剂的成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: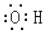 | ||
| C. | 苯酚的结构简式为C6H5OH | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 | |
| B. | 镀锌铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g);△H<0,则该反应一定能自发进行 | |
| D. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com