
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25 ℃)
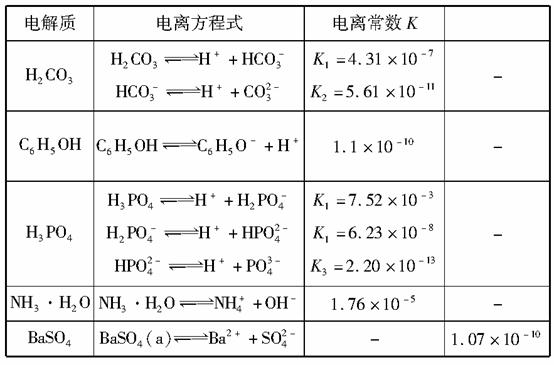
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:__________。
(2)25 ℃时,向10 mL 0.01 mol·L-1 C6H5OH溶液中滴加V mL 0.01 mol·L-1氨水,混合溶液中粒子浓度关系正确的是________(填序号)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH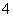 )=c(C6H5O-)+c(C6H5OH)
)=c(C6H5O-)+c(C6H5OH)
c.V=10时,混合液中水的电离程度小于0.01 mol·L-1 C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH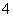 )>c(C6H5O-)>c(H+)>c(OH-)
)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义。25 ℃时,Na2CO3第一步水解反应的水解常数Kh=________mol·L-1。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
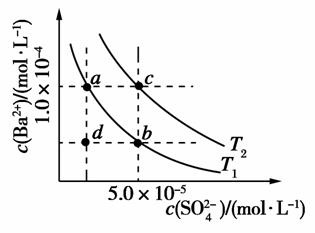
①T2________25℃(填“>”、“<”或“=”)。
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是________(填序号)。
a.加入Na2SO4不能使溶液a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
解析:本题考查了弱电解质的电离、溶度积常数及水常解数等知识,意在考查考生对平衡常数的理解及应用能力。(1)根据表中电离常数可知C6H5OH的酸性比HPO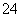 的酸性强,但比H2PO
的酸性强,但比H2PO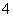 的酸性弱,故C6H5OH与Na3PO4反应生成Na2HPO4。(2)由表中数据可知,NH3·H2O的电离常数大于C6H5OH的电离常数,故V<10时,混合液也可能呈碱性,a项错误;当V=5时,由物料守恒可知2[c(NH3·H2O)+c(NH
的酸性弱,故C6H5OH与Na3PO4反应生成Na2HPO4。(2)由表中数据可知,NH3·H2O的电离常数大于C6H5OH的电离常数,故V<10时,混合液也可能呈碱性,a项错误;当V=5时,由物料守恒可知2[c(NH3·H2O)+c(NH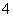 )]=c(C6H5OH)+c(C6H5O-),b项正确;当V=10时,相当于生成了C6H5ONH4,该物质水解,促进水的电离,而C6H5OH电离出H+,抑制水的电离,故V=10时,混合液中水的电离程度大于0.01 mol·L-1 C6H5OH溶液中水的电离程度,c项错误;由溶液中的电荷守恒可知c(NH
)]=c(C6H5OH)+c(C6H5O-),b项正确;当V=10时,相当于生成了C6H5ONH4,该物质水解,促进水的电离,而C6H5OH电离出H+,抑制水的电离,故V=10时,混合液中水的电离程度大于0.01 mol·L-1 C6H5OH溶液中水的电离程度,c项错误;由溶液中的电荷守恒可知c(NH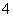 )+c(H+)=c(OH-)+c(C6H5O-),因混合液pH<7,c(H+)>c(OH-),故c(NH
)+c(H+)=c(OH-)+c(C6H5O-),因混合液pH<7,c(H+)>c(OH-),故c(NH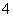 )<c(C6H5O-),d项错误。(3)Kh=
)<c(C6H5O-),d项错误。(3)Kh=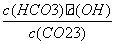 =
= =
= =
=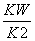 =
=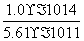 =1.78×10-4(mol·L-1)。(4)①由图中的c点可知,T2时,c(Ba2+)·c(SO
=1.78×10-4(mol·L-1)。(4)①由图中的c点可知,T2时,c(Ba2+)·c(SO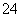 )=1.0×10-4×5.0×10-5=5.0×10-9>Ksp,故T2>25 ℃。②加入硫酸钠,溶液中的c(SO
)=1.0×10-4×5.0×10-5=5.0×10-9>Ksp,故T2>25 ℃。②加入硫酸钠,溶液中的c(SO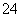 )增大,而Ksp不变,c(Ba2+)必然减小,由图像可知,加入硫酸钠,可以由a点变为b点,a项错误;在T1曲线上方区域(不合曲线),有c(Ba2+)·c(SO
)增大,而Ksp不变,c(Ba2+)必然减小,由图像可知,加入硫酸钠,可以由a点变为b点,a项错误;在T1曲线上方区域(不合曲线),有c(Ba2+)·c(SO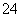 )>Ksp,因此均有硫酸钡沉淀生成,b项正确;蒸发溶剂,溶液中c(Ba2+)和c(SO
)>Ksp,因此均有硫酸钡沉淀生成,b项正确;蒸发溶剂,溶液中c(Ba2+)和c(SO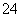 )均增大,可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),c项正确;升高温度,Ksp增大,但硫酸钡溶液中c(Ba2+)和c(SO
)均增大,可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),c项正确;升高温度,Ksp增大,但硫酸钡溶液中c(Ba2+)和c(SO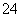 )始终相等,d项错误。
)始终相等,d项错误。
答案:(1)C6H5OH+PO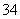 ===C6H5O-+HPO
===C6H5O-+HPO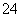
(2)b (3)1.78×10-4 (4)①> ②bc


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
已知酸性条件下有如下反应:2Cu+===Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物做了验证,实验操作和实验现象记录如下:
| 加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体和 蓝色溶液 | 无色气体和 蓝色溶液 | 无色气体和 蓝色溶液 | 红棕色气体 和蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物是 ( )
A.Cu B.Cu2O
C.一定有Cu,可能有Cu2O D.一定有Cu2O,可能有Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质溶液的叙述正确的是( )
A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH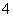 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量相同
D.将pH =4的盐酸稀释后,溶液中所有离子的浓度均降低
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃,某浓度的盐酸、氯化铵溶液中由水电离出的氢离子浓度分别为1.0×10-a mol·L-1、1.0×10-b mol·L-1,这两种溶液的pH之和为( )
A.14-a+b B.14+a+b
C.14-a-b D.14+a-b
查看答案和解析>>
科目:高中化学 来源: 题型:
食品抗氧化剂是能阻止或延缓食品氧化变质、提高食品稳定性和延长贮存期的食品添加剂。BHT是一种常用的食品抗氧化剂,合成方法有如下两种:
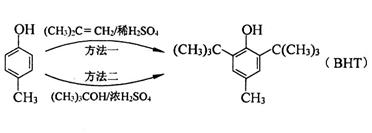
下列说法不正确的是

C.BHT不能与NaHCO3溶液反应生成CO2
D.两种方法的反应类型都是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中属于电解质的正确组合是
①胆矾 ②冰醋酸 ③液氨 ④氧化钠⑤硫酸钡⑥氯水⑦乙醇⑧食盐水 ⑨干冰
A.①③⑤⑦⑨ B.①②④⑤ C.①②③⑥⑨ D.②③⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25%氨水的密度为0.91克/厘米3,5%氨水的密度为0.98克/厘米3,若将
上述两溶液等体积混合,所得氨水溶液的质量分数是
A.等于15% B.大于15% C.小于15% D.无法估算
查看答案和解析>>
科目:高中化学 来源: 题型:
如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。将所选答案 的编号填入下表内相应的空格内(如果不需要外加试剂,则对应答案栏可空着)。
可供选择的试剂:A.盐酸 B.氢氧化钠溶液 C.氧气 D.水 E.二氧化碳
可选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶
|
| 粉末状混合物 | 选择的试剂 | 选用的操作 |
| (1) | CaCO3(SiO2) | ||
| (2) | NaCl(SiO2) | ||
| (3) | SiO2(Fe2O3) | ||
| (4) | SiO2(CaCO3) | ||
| (5) | SiO2(NH4Cl) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com