


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A.若R(OH)n为强碱,则W(OH)n+1也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山西省高三上学期第二次月考化学卷 题型:选择题
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(均为正整数)( )
A.若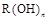 为强碱,则
为强碱,则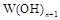 也为强碱
也为强碱
B.若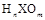 为强酸,则Y是活泼非金属元素
为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为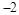 ,则Z的最高正化合价为
,则Z的最高正化合价为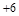
D.若X的最高正化合价为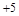 ,则五种元素都是非金属元素
,则五种元素都是非金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com