
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;
步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将
(填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
【知识点】离子方程式书写、酸碱中和滴定B1 H2
【答案解析】(1)K2SiF6+3H2O=2KF+H2SiO3+4HF HF+OH-=F-+H2O;(2)偏高
(3) 由题中数据可得出消耗氢氧化钠标准溶液体积的平均值为20.00mL
关系式:SiO2 ~Si~4HF~4NaOH
60g 4mol
m 20.00×103L×1.0mol/L
求得m=0.30g
硅元素的质量分数(以二氧化硅计):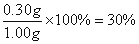
解析:(1)氟硅酸钾(K2SiF6)沉淀分离后于热水中水解,生成HF、H2SiO3、KF,水解反应方程式为K2SiF6+3H2O=2KF+H2SiO3+4HF ;
步骤③中反应的离子方程式为:HF+OH-=F-+H2O。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,氢氧化钠标准溶液被稀释,导致消耗氢氧化钠溶液体积偏大,则测得的硅元素含量将偏高;(3)由题中数据可得出消耗氢氧化钠标准溶液体积的平均值为20.00mL
关系式:SiO2 ~Si~4HF~4NaOH
60g 4mol
m 20.00×103L×1.0mol/L
求得m=0.30g
硅元素的质量分数(以二氧化硅计):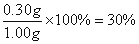
【思路点拨】本题考查了离子方程式书写、酸碱中和滴定,计算时正确列关系式是关键。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
对于密闭容器中的可逆反应:mX(g)+nY(s)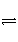
 pZ(g) ΔH<0,达化学平衡后,改变条件,下列表述不正确的是( )
pZ(g) ΔH<0,达化学平衡后,改变条件,下列表述不正确的是( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其它条件不变,升高温度,化学平衡一定发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列有关电解质溶液的叙述正确的是 ( )
A.等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7
B.pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性
C.pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg 2=0.3)
D.将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液> Fe(OH)3胶体> FeCl3溶液
B.能自发进行的化学反应,一定是 H<0、
H<0、 S>0
S>0
C.焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化
D.钢铁发生电化学腐蚀时,负极的电极反应式为Fe-3e-= Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.等物质的量浓度的硫酸氢铵溶液和氢氧化钠溶液等体积混合:
c(S042-)>c(Na+)>C(NH4+)>c(OH-)=c(H+)
B.常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系: c(HB)>c(Na+)>c(B-)>c(H+)>c(OH-)
C.在滴有酚酞溶液的氨水中,加入NH4CI的溶液恰好无色,则此时溶液的PH<7
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,若混合液pH=7,则溶液中:2c(R2-)+c(HR-)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是某煤化工产业链的一部分,试运用所学知识,解决下列问题:
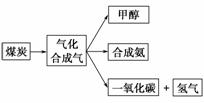
1)已知该产业链中某反应的平衡常数表达式为K=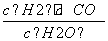 ,它所对应反应的化学方程式是
,它所对应反应的化学方程式是
____________________________________________________。
2)合成甲醇的主要反应是2H2g)+COg)CH3OHg) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度mol·L-1) | 0.2 | 0.1 | 0.4 |
①该时间段内反应速率vH2)=________。
②比较此时正、逆反应速率的大小:v正________v逆填“>”、“<”或“=”)。
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡 ________填“逆向”、“正向”或“不”)移动,平衡常数K________填“增大”、“减小”或“不变”)。
3)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2g)+O2g)===2NOg) ΔH=+180.8 kJ·mol-1,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是________填字母序号)。
| 反应 | 大气固氮 | 工业固氮温度/℃ | ||||
| 27 | 2 000 | 25 | 350 | 400 | 450 | |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.模拟大气固氮应用于工业上的意义不大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在常温常压下:
①2CH3OHl)+3O2g)===2CO2g)+4H2Og)
ΔH1=-1 275.6 kJ·mol-1
②2COg)+O2g)===2CO2g)
ΔH2=-566.0 kJ·mol-1
③H2Og)===H2Ol) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________________________________________________________
____________________________________________________。
2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2g)+O2g)===2NOg)
ΔH=+180.5 kJ·mol-1
2H2g)+O2g)===2H2Ol)
ΔH=-571.6 kJ·mol-1
则H2g)与NOg)反应生成N2g)和H2Ol)的热化学方程式为________________________________________________________
____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解200 mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。

(1)下列说法正确的是______(填序号)。
A.电解过程中,b电极表面先有红色物质析出,后有气泡产生
B.a电极上发生的反应为2H++2e-===H2↑和4OH--4e-===2H2O+O2↑
C.从P点到Q点时收集到的混合气体的平均摩尔质量为12 g·mol-1
D.OP段表示H2和O2混合气体的体积变化,PQ段表示O2的体积变化
(2)如果要使溶液恢复到电解前的状态,向溶液中加入0.8 g CuO即可,则电解后溶液的pH为______。
(3)如果向所得的溶液中加入0.1 mol Cu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为______mol。
(4)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:反应CaCO3(s)===CaO(生石灰,s)+CO2(g)
ΔH(298.15 K)=178.3 kJ·mol-1
ΔS(298.15 K)=169.6 J·mol-1·K-1。通过计算判断此反应在室温下能否自发进行,并粗略计算此反应能自发进行的最低温度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com