
(本题包括2部分,共14分)
Ⅰ、(8分)X、Y、Z、W均为短周期元素组成的单质或化合物。在一定条件下有如下转化关系:X+Y→Z+W
(1)若构成X的阳、阴离子个数比为1︰2,且构成X的阳、阴离子中分别含有18个和10个电子,构成Z的阴、阳离子中均含有10个电子。则Z的电子式为 。
(2)若X、Y、Z、W四种物质均为分子,且X分子中含18个电子,Y、Z分子中均含有10个电子,单质W分子中含有16个电子。则此化学反应的类型为 。
(3)若X、W均为单质,Y、Z均为氧化物且Y、Z中氧的质量分数分别为50%和40%。则该反应的化学方程式为 。
(4)若X、Y、Z、W均为非金属氧化物,X的式量比Z的式量小16,Y的式量比W的式量大16,Y是光化学烟雾的主要“元凶”,则该反应的化学方程式为 。
Ⅱ、(6分)我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:
请根据以上信息回答下列问题:
(1)写出N的化学式和B的名称:N 、B 。
(2)写出反应②的化学方程式并用双线桥表示电子转移情况:
(3)写出反应③的离子方程式:
Ⅰ、(1)NaOH的电子式: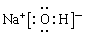 ;(2分)(2)置换反应(氧化还原反应)
;(2分)(2)置换反应(氧化还原反应)
(3)2Mg+SO2 2MgO+S(2分)(4)SO2+NO2=SO3+NO(或CO+NO2=CO2+NO)(2分)
2MgO+S(2分)(4)SO2+NO2=SO3+NO(或CO+NO2=CO2+NO)(2分)
Ⅱ、(1)HCl (1分)、石灰乳(1分)(2)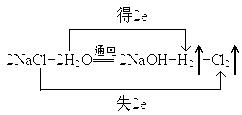
(3)Cl2 + 2OH- =Cl- + ClO- +H2O(2分)
解析试题分析:Ⅰ、(1)若构成X的阳、阴离子个数比为1︰2,且构成X的阳、阴离子中分别含有18个和10个电子,构成Z的阴、阳离子中均含有10个电子。则X是Ca(OH)2;Y是Na2CO3,Z是NaOH,W是CaCO3,Z的电子式为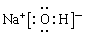 ;(2)若X、Y、Z、W四种物质均为分子,且X分子中含18个电子,Y、Z分子中均含有10个电子,单质W分子中含有16个电子。则X是F2,Y是H2O,Z是HF,W是O2,由于在反应中元素的化合价发生了变化,所以此化学反应的类型为氧化还原反应,根据反应物和生成物的元素组成可知该反应同时也是置换反应;(3)若X、W均为单质,Y、Z均为氧化物且Y、Z中氧的质量分数分别为50%和40%。则该反应的化学方程式为2Mg+SO2
;(2)若X、Y、Z、W四种物质均为分子,且X分子中含18个电子,Y、Z分子中均含有10个电子,单质W分子中含有16个电子。则X是F2,Y是H2O,Z是HF,W是O2,由于在反应中元素的化合价发生了变化,所以此化学反应的类型为氧化还原反应,根据反应物和生成物的元素组成可知该反应同时也是置换反应;(3)若X、W均为单质,Y、Z均为氧化物且Y、Z中氧的质量分数分别为50%和40%。则该反应的化学方程式为2Mg+SO2 2MgO+S;(4)若X、Y、Z、W均为非金属氧化物,X的式量比Z的式量小16,Y的式量比W的式量大16,Y是光化学烟雾的主要“元凶”,则X是SO2;Y是NO2;Z是SO3;W是NO;该反应的化学方程式为SO2+NO2=SO3+NO(或X是CO;Y是NO2;Z是CO2;W是NO,反应的方程式是CO+NO2=CO2+NO);
2MgO+S;(4)若X、Y、Z、W均为非金属氧化物,X的式量比Z的式量小16,Y的式量比W的式量大16,Y是光化学烟雾的主要“元凶”,则X是SO2;Y是NO2;Z是SO3;W是NO;该反应的化学方程式为SO2+NO2=SO3+NO(或X是CO;Y是NO2;Z是CO2;W是NO,反应的方程式是CO+NO2=CO2+NO);
Ⅱ、(1)贝克CaCO3煅烧得到A是CaO, CaO与水发生反应产生B:Ca(OH)2,饱和NaCl溶液电解产生E是NaOH;F是H2;C是Cl2;氯气与氢气化合产生N:HCl,Cl2与NaOH溶液发生反应产生NaClO;Ca(OH)2与含有MgCl2的溶液发生复分解反应产生Mg(OH)2沉淀,把沉淀过滤出来,与HCl发生酸碱中和反应产生MgCl2;电解熔融的MgCl2产生C:Cl2和D:Mg。(1)N的化学式是HCl;B的名称是石灰乳;
(2)反应②的化学方程式及用双线桥表示电子转移情况是 ;
;
(3)反应③氯气与NaOH溶液反应的两种方程式是:Cl2 + 2OH- =Cl- + ClO- +H2O。
考点:考查元素及化合物的推断、物质的化学式、电子式、化学方程式的书写、反应类型的判断的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.将高温水蒸气通过炽热的铁粉,铁粉变红色 |
| B.向Fe(OH)3胶体中滴加稀H2SO4,先出现沉淀,后沉淀溶解 |
| C.将市售食盐溶于水,滴加淀粉溶液不变蓝色,说明不是加碘盐 |
| D.Cu的金属活泼性比Fe弱,故水库铁闸门上接装铜块可减缓铁腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质中不能用化合反应的方法制得的是
①SiO2 ②H2SiO3 ③Fe(OH)3 ④Al(OH)3 ⑤FeCl2 ⑥ CaSiO3
| A.①③ | B.②④ | C.②③④⑤ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(10分)已知A~H是中学化学中的常见物质,A、C、G是金属,E、F是氧化物,B溶于水得蓝色溶液,它们有如下图所示的关系(反应中生成的水已略去)。
试回答下列问题。
(1)推断填写物质化学式:A是 ,D是 ,H是 。
(2)F的类别是 (选填“酸性氧化物”、“碱性氧化物”或“两性氧化物”)。
(3)反应④的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(6分)下图所示各物质是由短周期部分元素组成的单质或其化合物,图中部分反应条件及物质未列出。已知:A、C、D、F均为单质,C、E、F、G常温下是气体,J为白色沉淀,既能溶于B,又能溶于E;物质B、G可以使湿润的红色石蕊试纸变蓝,且B的焰色反应呈黄色。反应④是化肥工业的重要反应。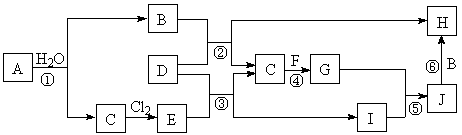
请回答下列问题:
(1)A的元素在元素周期表中的位置是 ,物质B的电子式为 。
(2)上述反应①~⑥中,属于化合反应的是 ,反应⑤的离子方程式为 。
(3)在I的水溶液滴加B溶液至过量的过程中,所观察到的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(14分)A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,B是短周期中金属性最强的元素,C是同周期中阳离子半径最小的元素,D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,E的最外层电子数与内层电子数之比为3﹕5。请回答:
(1)D的元素符号为 。
(2)F在元素周期表中的位置 。
(3)用电子式表示元素B与元素F形成的化合物: 。
(4)B单质与氧气反应的产物与C的单质同时放入水中,产生两种无色气体,有关的化学方程式为 、 。
(5)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为 。
(6)某混合物的稀溶液中,只可能含有B、C、F构成的简单离子或A、E的最高价氧化物对应水化物所电离出来的阴离子。现分别取一定体积的该溶液进行实验。两次每次取200.00mL进行实验。
实验1:取2mL溶液,向其中加入AgNO3溶液有沉淀产生;
实验2:取200mL溶液,向其中加入足量BaCl2溶液后,得干燥沉淀12.54g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g。请回答:
①根据以上实验,不能判断是否存在的离子有 。
② B的简单离子是否存在 ;若存在,浓度至少为 mol/L(若不存在,则不必回答第二问)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学反应伴随能量变化,下列说法中错误的是
| A.TNT(炸药)爆炸时部分化学能转化为热能 |
| B.电解饱和食盐水时部分化学能转化为电能 |
| C.镁条燃烧时部分化学能转化为光能 |
| D.植物光合作用时部分光能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
未来新能源的特点是资源丰富,可以再生,在使用过程中对环境无污染或污染很小。下列符合未来新能源标准的是
①天然气 ②风能 ③石油 ④太阳能 ⑤生物质能 ⑥煤 ⑦氢能
| A.①④⑥⑦ | B.②④⑤⑦ | C.①②③⑥ | D.②④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com