
分析 (1)根据铝与NaOH溶液反应的性质设计实验方案;
(2)A.浓硫酸易使铁、铝钝化,不能使合金溶解;
B.活泼金属与稀硫酸反应;
C.稀硝酸与金属反应生成污染性气体;
D.铁不与NaOH溶液反应.
解答 解:(1)铝与NaOH溶液反应生成气体,反应的化学方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,所以可用NaOH溶液检验所得的块状熔融物中含有金属铝,
故答案为:NaOH溶液;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)A.浓硫酸易使铁、铝钝化,不能使合金溶解,故A错误;
B.活泼金属与稀硫酸反应,熔融物可溶解于稀硫酸中,故B正确;
C.稀硝酸与金属反应生成污染性气体,不是最佳选择,故C错误;
D.铁不与NaOH溶液反应,不能将熔融物全部溶解,故D错误;
故答案为:B.
点评 本题考查铝热反应,金属与硝酸的反应、离子方程式的书写、氧化还原反应,侧重考查学生的分析、实验能力,注意把握物质的性质,难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. |  由图可知,a点Kw的数值比b点Kw的数值大 | |
| B. |  表示在相同的密闭容器中,不同温度下的反应,该反应的△H<0 | |
| C. | 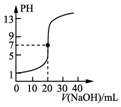 表示0.100 0 mol•L-1 NaOH溶液滴定20.00 mL 0.100 0 mol•L-1醋酸溶液的滴定曲线 | |
| D. |  表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(A)>ω(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氧化铝与稀硫酸反应Al2O3+6H+═2Al3++3H2O | |
| C. | 氢氧化铝与稀硝酸反应OH-+H+═H2O | |
| D. | 铜与稀硝酸反应:Cu+2H++2NO3-═Cu2++2NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子由Zn极流向Cu极 | B. | 此装置能将电能转变为化学能 | ||
| C. | 取出盐桥,电流表指针不再偏转 | D. | 该装置的总反应:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s12p1表示的是激发态原子的电子排布 | |
| B. | 3p2表示3p能级有两个轨道 | |
| C. | 同一原子中,3d轨道的能量小于4s轨道的能量 | |
| D. | 同一原子中,2p、3p、4p电子的能量逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学利用如图所示装置制备乙酸乙酯.实验如下:
某同学利用如图所示装置制备乙酸乙酯.实验如下:| A. | ①中加热利于加快酯化反应速率,故温度越高越好 | |
| B. | ③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致 | |
| C. | ③中红色褪去的原因可能是酚酞溶于乙酸乙酯中 | |
| D. | 取②中上层油状液体测其核磁共振氢谱,共有3组峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 PH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )
PH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )| A. | ①④ | B. | ②③ | C. | ①② | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH- )=c(CH3COO-)-c(CH3COOH) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+ )>c(OH? )=c(H+) | |
| D. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl- )+c(ClO- )+c(OH? ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com