
某溶液中Cl-、Br-、I- 三者物质的量之比为2︰3︰4,要使溶液中Cl-、Br-、I- 物质的量之比为1︰1︰1,则通入Cl2的物质的量是原溶液中I- 物质的量的
A.1/2 B.1/3 C.1/4 D.1/8
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源:2015-2016学年陕西省高二上诊断检测化学试卷(解析版) 题型:选择题
关于电解饱和NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省衡水市高一上第四次月考化学试卷(解析版) 题型:选择题
下列各组物质与其用途的关系不正确的是
A.过氧化钠:供氧剂 B.烧碱:治疗胃酸过多的一种药剂
C.氧化铝:耐火坩埚 D.明矾:净水剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西钦州港经济开发区中学高一上12月月考化学试卷(解析版) 题型:选择题
某有机物分子中有 n 个-CH 2 -, m 个 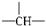 ,a个-CH 3 ,其余为-OH,则该物质分子中OH的个数可能为
,a个-CH 3 ,其余为-OH,则该物质分子中OH的个数可能为
A.m-a B.n+m+a C.m+1-a D.m+2-a
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北大名县一中高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.Na2O2溶于水中:Na2O2+H2O═2Na++2OH-+O2↑
B.用FeC13溶液腐蚀电路板:Cu+Fe3+═Cu2++Fe2+
C.向NaAlO2溶液中通入过量CO2气体:AlO2-+CO2+2H2O═Al(OH)3+HCO3-
D.CaCO3与盐酸反应: CO32-+2H+═CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上学期期中考试化学试卷(解析版) 题型:填空题
乙苯催化脱氢制苯乙烯反应:
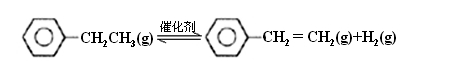
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=____________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________ (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和 水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
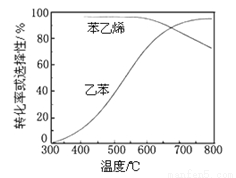
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实______________。
②控制反应温度为600℃的理由是 ____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有__________(填编号)。
① CO2与H2反应,使乙苯脱氢反应的化学平 衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上学期12月月考化学试卷(教师版) 题型:选择题
对于:2H2(g) + O2(g) =2H2O(l) △H = —571.6kJ/mol的叙述错误的是
A.该反应的反应热为△H = —571.6kJ/mol ,是放热反应
B.该反应的△H与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25℃、101 kPa下,2mol氢气完全燃烧生成液态水时放出热量571.6kJ
kPa下,2mol氢气完全燃烧生成液态水时放出热量571.6kJ
D.该反应为氢气燃烧的热化学方程式,由此可知氢气的燃烧热为571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016届广东省顺德市高三上第四次月考理综化学试卷(解析版) 题型:填空题
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
(一)高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数 如下:
温度/℃ 1000 1115 1300
平衡常数 4.0 3.7 3.5
(1)该反应的平衡常数表达式K=___;△H___0(填“>”、“<”或“=”).
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是_____.
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正___υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=_____.
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是_____;生成1mol K2FeO4转移电子的物质的量是_____mol.
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期月考化学试卷(解析版) 题型:选择题
将一定量的铜粉加入到100mL某浓度的稀硝酸中充分反应后,容器中剩有m1g 铜粉,此时共收集到NO气体448mL(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2g ,则(m1-m2)为
A.5.76 B.2.88 C.1.92 D.0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com