
图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
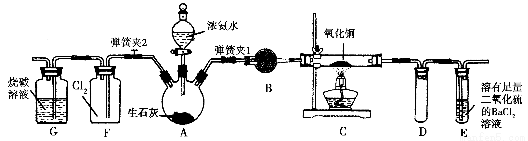
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先________,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生________(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________________________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是_________
__________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:____________________,迅速产生倒吸的原因是____________________________。
(1)关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水
(2)碱石灰(或生石灰)
(3)白色沉淀 2NH3+3CuO 3Cu+N2↑+3H2O
3Cu+N2↑+3H2O
(4)Cu2O、Cu
(5)3Cl2+8NH3=N2+6NH4Cl
盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致瓶内压强减小,引起溶液倒吸
【解析】A是制备NH3的装置,B是干燥NH3的装置,C是NH3与CuO的反应装置,E是处理NH3的尾气装置,F是NH3与Cl2的反应装置,G是处理尾气Cl2的装置。
(2)干燥NH3需使用碱性干燥剂。(3)C中CuO与NH3发生氧化还原反应生成红色的Cu、N2和H2O;E中发生反应:2NH3+BaCl2+SO2+H2O=BaSO3↓+2NH4Cl。(4)若产物全部是Cu,则由差量法知减小的部分全部是O元素的质量,即n(CuO)=n(O)=2.4 g÷16 g·mol-1=0.15 mol,所以反应的CuO的质量为0.15 mol×80 g/mol=12 g<16 g,所以CuO未完全转化成Cu,剩余固体中可能含有Cu2O。(5)Cl2可将NH3氧化为N2,同时生成的HCl会和NH3反应生成NH4Cl,产生白烟现象,F瓶内压强变小从而出现倒吸现象。
点拨:本题考查NH3的制备及性质、化学实验基本操作,考查考生记忆和知识的应用能力。难度中等。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质的量及其应用练习卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等
B.标准状况下,28 g CO和22.4 L SO3所含分子数相等
C.5.6 g铁粉与足量氯气充分反应,有0.2 mol电子转移
D.等物质的量的CH5+和NH2—所含电子数相等
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 常见无机物及其应用练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.硅主要以单质、氧化物、硅酸盐的形式存在于自然界中
B.青铜是我国使用最早的合金,钢是用量最大、用途最广泛的合金
C.漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂
D.合成纤维和光导纤维都是高分子化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化工生产流程、无机物的判断练习卷(解析版) 题型:选择题
如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是( )

A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学能与热能练习卷(解析版) 题型:选择题
已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH1=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH2=-57.3 kJ·mol-1
③Ba2+(aq)+SO42—(aq)=BaSO4(s) ΔH3<0
下列说法正确的是( )
A.HF的电离方程式及热效应:HF(aq)=H+(aq)+F-(aq) ΔH>0
B.在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大
C.ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热
D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学实验基础练习卷(解析版) 题型:选择题
下列化学实验事实及其解释都正确的是( )
A.向KMnO4溶液中滴加盐酸,KMnO4溶液的氧化能力增强。说明盐酸具有氧化性
B.向澄清的AlCl3稀溶液中加入NaOH浓溶液,振荡,溶液仍为澄清。说明该两种溶液混合是物理变化
C.向FeCl3溶液中加入过量Cu粉,振荡、静置,溶液由黄色变为绿色。说明Fe3+具有氧化性
D.向CaCl2溶液中滴入少量Na2CO3溶液,产生白色沉淀。说明CaCO3难溶于水
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学实验基础练习卷(解析版) 题型:选择题
有一无色透明溶液,可能含有Na+,Al3+,Mg2+,Fe3+,NH4+,Cl-,SO42—,HCO3—中的几种,取该溶液三份分别进行实验:①滴加甲基橙溶液显红色;②逐渐加入NaOH溶液,产生白色沉淀,最后白色沉淀部分溶解;③加入5 mL 0.1 mol·L-1 BaCl2溶液至不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.2 g沉淀。由此推知,原溶液中( )
A.一定有Al3+,Mg2+,Cl-,SO42—
B.一定没有Mg2+,Fe3+,HCO3—
C.不能确定是否含有Cl-
D.可能有Na+,NH4+,Cl-,SO42—
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本理论练习卷(解析版) 题型:选择题
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO2为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO2为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6?5.3
B.若反应开始时容器体积为2 L,则有v(SO3)=0.35 mol/(L·min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学反应速率与化学平衡练习卷(解析版) 题型:填空题
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:A(g)  B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________。
(2)由总压强p和起始压强P0计算反应物A的转化率a(A)的表达式为________,平衡时A的转化率为________,列式并计算反应的平衡常数K________。
(3)①由总压强p和起始压强P0表示反应体系的总物质的量n(总)和反应物A的物质的量n(A),n(总)=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
分析该反应中反应物的浓度c(A)变化与时间间隔(t)的规律,得出的结论是________,由此规律推出反应在12 h时反应物的浓度c(A)为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com