
| 5 |
| 2 |
| A、10个电子转移时,该反应放出1300kJ的能量 |
| B、NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C、有2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D、有8NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| 10 |
| NA |
| ||
| 10 |
| 1 |
| NA |
| 1 |
| NA |
| 1300 |
| NA |
| 5 |
| 2 |
| 1300KJ |
| 4 |


科目:高中化学 来源: 题型:
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 没有现象发生 |
| ② | B+D | 有气体放出 |
| ③ | B+C | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X基态原子中成对电子与未成对电子数之比为4:3 |
| Y | Y基态原子L层电子数是K层的3倍 |
| Z | Z元素在自然界中存在质量数为35和37的两种核素 |
| W | W为一种常见金属,能形成多种氧化物,其中有一种具有磁性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
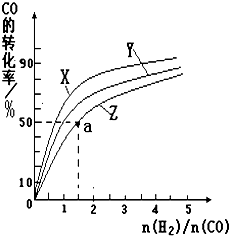 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
| OH- |
| H+ |
| OH- |
| H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加入Ba(NO3)2溶液后产生白色沉淀,则原溶液中一定含有SO42- |
| B、向某稀溶液中加入Ba(NO3)2溶液后无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明一定是氯化物的溶液 |
| C、将盛满H2的小试管管口向上靠近酒精灯火焰检验H2的纯度 |
| D、将燃着的木条靠近导管口,木条熄灭,说明有CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水中提取氯化钠的过程涉及化学反应 |
| B、从海带中提取碘单质的过程涉及置换反应 |
| C、从海水中提取溴单质的过程涉及氧化还原反应 |
| D、海水中含有氯化钠等多种氯化物;除了氯,海水中溴的储量也很高,溴也被称为“海洋元素” |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫溶于水能导电,故二氧化硫属于电解质 |
| B、铜可以导电,故铜是电解质 |
| C、硫酸钡难溶于水,故硫酸钡属于弱电解质 |
| D、氢离子浓度相同的盐酸和醋酸导电能力相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com