
| A. | K+,Cu2+,OH-,HCO3- | B. | Mg2+,NH4+,Br-,SO42- | ||
| C. | Ca2+,Fe3+,Cl-,CO32- | D. | Fe2+,H+,ClO-,SiO32- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应,不能相互促进水解等,则离子大量共存,以此来解答.
解答 解:A.Cu2+、OH-结合生成沉淀,OH-、HCO3-结合生成水和碳酸根离子,不能大量共存,故A错误;
B.该组离子之间不反应,可大量共存,故B正确;
C.Ca2+、CO32-结合生成沉淀,Fe3+、CO32-相互促进水解,不能大量共存,故C错误;
D.Fe2+、H+、ClO-发生氧化还原反应,H+、SiO32-结合生成沉淀,不能大量共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、水解反应、复分解反应的离子共存考查,综合性较强,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 某同学在研究前18号元素时发现,可以将它们按原子序数递增的顺序排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素..
某同学在研究前18号元素时发现,可以将它们按原子序数递增的顺序排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素..| 共价键 | H-F | H-Cl | H-O | H-S | H-N | H-P |
| 键长(pm) | 92 | 127 | 98 | 135 | 101 | 321 |
| 键能(kJ•mol-1) | 568 | 432 | 464 | 364 | 391 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油主要是由烃组成的混合物 | B. | ①主要发生物理变化 | ||
| C. | ②包括裂化,裂解等过程 | D. | ③中产物名称是二溴已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )分子的一氯代物有2种.
)分子的一氯代物有2种. 系统命名为3-甲基-2-乙基-1-丁烯
系统命名为3-甲基-2-乙基-1-丁烯 请写出其单体结构:
请写出其单体结构: 、
、 、
、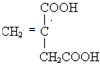 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,在过氧化钠晶体中阴、阳离子的个数比为1:2;
,在过氧化钠晶体中阴、阳离子的个数比为1:2;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com