
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | N、O、F电负性依次增大 | |
| C. | P、S、Cl元素最高正价依次升高 | |
| D. | Na、K、Rb第一电离能逐渐增大 |
分析 A.同周期元素的原子,从左到右,最外层电子数依次增多;
B.同周期元素从左到右电负性逐渐增强;
C.元素最高正价=最外层电子数;
D.同一主族元素,从上到下,第一电离能逐渐减小.
解答 解:A.Li、Be、B原子最外层电子数依次为1、2、3,逐渐增多,故A正确;
B.同周期元素从左到右电负性逐渐增强,N、O、F电负性依次增大,故B正确.
C.P、S、Cl元素最高正价依次为+5、+6、+7,逐渐升高,故C正确;
D.同一主族元素,从上到下,原子半径逐渐增大,失电子能力增强,第一电离能逐渐减小,Na、K、Rb第一电离能逐渐减小,故D错误;
故选D.
点评 本题考查了元素周期表中同周期、同主族元素原子的结构、性质变化规律及应用,熟悉元素周期律是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 纯净物 | 混合物 | 弱电解质 | 非电解质 |
| A | 明矾 | 铝热剂 | BaSO4 | CO2 |
| B | 氨水 | 石膏 | SO2 | CH3CH2OH |
| C | 苏打 | 氢氧化铁胶体 | H2SiO3 | NH3 |
| D | 胆矾 | 钢铁 | H2CO3 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
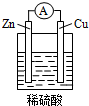 在如图用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在如图用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )| A. | 锌片是正极,铜片上有气泡产生 | |
| B. | 电流方向是从锌片流向铜片 | |
| C. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| D. | 电解液的PH值逐渐减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe-4e-═2Fe2+ | B. | 2Fe2++4e-═2Fe | ||
| C. | 2H2O+O2+4e-═4OH- | D. | 2Fe3++2e-═2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+2Br-═2Cl-+Br2、Zn+Cu2+═Zn2++Cu均为单质被还原的置换反应 | |
| B. | 2Na2O2+2H2O═4NaOH+O2↑、Cl2+H2O═HCl+HClO均为水作还原剂的氧化还原反应 | |
| C. | Cl元素的单质在化学反应中只表现氧化性 | |
| D. | NaSO3与H2O2的反应为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,pH=12的NaOH溶液中含有OH-的数目为0.01 NA | |
| B. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,在该反应中,当有3NA电子转移时,上述热化学反应方程式的焓变为△H=-46.2KJ/mol | |
| C. | 2.3g金属钠与过量氧气充分反应,无论加热与否转移电子数为0.1NA | |
| D. | 50mL 18.4mo1/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com