
钛是一种性能非常优越的金属,它化学性质稳定,耐腐蚀、钛及钛合金主要用于飞机、火箭、导弹、人造卫星和宇宙飞船等领域,某实验室模拟硫酸法生产二氧化钛,实验流程如下:
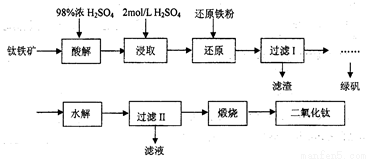
(1)酸解过程中发生的主要反应如下:FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O 请补充生成TiOSO4的化学方程式________________________________________;
(2)若取5g钛铁矿(主要成分是FeTiO3,含少量Fe2O3)于蒸发皿,加适量98%浓硫酸(密度1.84g/cm3)加热,请选择最接近的浓硫酸的用量_____________(填序号)。
A.2mL B.6mL C.25mL D.100mL
(3)在酸解后的浸取过程中,为提高浸出率可采用的方法有_____________。(任答一点)
(4)加“还原铁粉”的目的_____________。
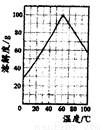
(5)请根据FeSO4溶解度曲线,补充由过虑I中滤液获得副产品绿矾(FeSO4·7H2O)的具体操作:取过滤I所得的滤液_______________________________________________________________。
(6)“水解”过程的操作步骤:将滤液加热至90℃,加6~7倍体积的溺水,保持沸腾60min,减压过滤,用2mol/LH2SO4溶液洗涤沉淀,请思考,“将滤液加热至90℃”作用是_____________________________。沉淀用2mol/LH2SO4溶液洗涤而不是用水洗涤的原因_____________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年浙江省宁波市高二下学期期中考试化学试卷(解析版) 题型:选择题
1升0.1mol/L氨水所含溶质微粒的物质的量是
A.0.1molNH3分子
B.0.1molNH3•H2O分子
C.NH3分子和NH3•H2O分子共0.1mol
D.NH3分子、NH3•H2O分子和NH4+共0.1mol
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三三诊理综化学试卷(解析版) 题型:选择题
化学与生活、生产实际密切相关。下列有关说法不正确的是
A.光导纤维应避免在强碱环境中使用
B.船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用
C.部分卤代烃可用作灭火剂
D.油脂皂化生成的高级脂肪酸钠是肥皂的有效成分
查看答案和解析>>
科目:高中化学 来源:2016届辽宁师大附中高三下学期精品考试理综化学试卷(解析版) 题型:填空题
氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
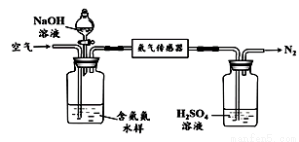
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
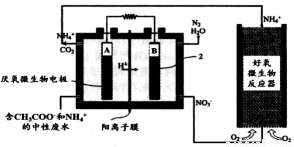
① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:选择题
常温下,用0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是
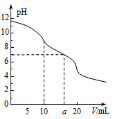
A.当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
B.当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D.当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:选择题
用下列装置进行相应实验,能达到实验目的的是
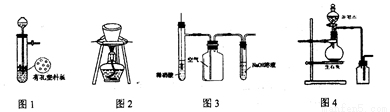
A. 图1所示装置用于Cu和浓硫酸反应制取少量的SO2气体
B. 图2装置用于除去碳酸氢钠固体中的少量碳酸钠
C. 图3装置用于制备并收集NO气体
D. 图4所示装置制取并收集氨气
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:填空题
A、B、C、D均为短周期元素,他们的原子序数依次增大,B是构成物质种类最多的元素,B和A组成的化合物 B6 A 6 是一种无色透明的液体,不溶于水,密度比水小,C 是地壳中含量最高的非金属元素,D 在同周期元素中原子半径最大。
(1)A、B、D 的元素名称分别为___________、____________、___________
(2)C 在元素周期表中位置为___________________。
(3)A、C、D 能组成多种不同的化合物,这些化合物中既含有极性共价键又含有离子键的化合物为_______________(写电子式,下同),既含有非极性共价键又含有离子键的化合物为_________________。
(4)A 和 D 能组成一种化学活性很高的离子化合物 DA,DA 能和C的单质 C2反应生成一种强碱,请写出 DA 和 C2反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高一6月月考化学试卷(解析版) 题型:简答题
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g)  H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:

试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减 小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母)
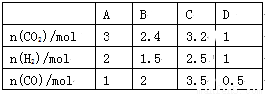
(4)在830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com