
������̼�Ļ��������ǻ��������о��ȵ㡣
��1����̫���ܵ������£���CO2Ϊԭ����ȡ̿�ڵ���������ͼ��ʾ���ܷ�Ӧ�Ļ�ѧ����ʽΪ ��

��2����һ����CO2�����״�ȼ�ϵķ�����CO2��3H2 CH3OH��H2O����֪298K��101KPa�����£�
CH3OH��H2O����֪298K��101KPa�����£�
CO2(g)��3H2(g) CH3OH(g)��H2O(l) ��H����a kJ��mol��1��
CH3OH(g)��H2O(l) ��H����a kJ��mol��1��
2H2(g)��O2(g)��2H2O(l) ��H����b kJ��mol��1��
CH3OH(g)��CH3OH(l) ��H����c kJ��mol��1��
��CH3OH(l)�ı�ȼ���ȡ�H��___________________��
��3��CO2�������⻯�ϳɵ�̼ϩ�����ϳ���ϩ��ӦΪ
2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) ��H<0
CH2= CH2(g) +4H2O(g) ��H<0
�ں����ܱ������г���2 mol CO2��n mol H2����һ�������·�����Ӧ��CO2��ת�������¶ȡ�Ͷ�ϱ� �Ĺ�ϵ����ͼ��ʾ��
�Ĺ�ϵ����ͼ��ʾ��
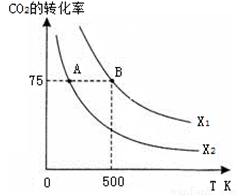
��ƽ�ⳣ��KA KB
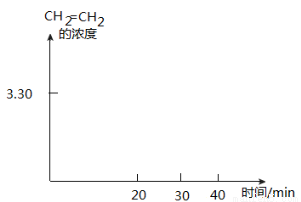
��T Kʱ��ij�ܱ���������������Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
ʱ��(min) Ũ��(mol��L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min��ֻ�ı���ijһ�����������ϱ��е������жϸı������������
A��ͨ��һ����H2 B��ͨ��һ����CH2=CH2
C��������ʴ��� D����С�������
����CH2=CH2��Ũ���淴Ӧʱ��ı仯���ߡ�
��4���ڴ���M�������£�CO2��H2ͬʱ��������������Ӧ
A��2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) ��H< 0
CH2= CH2(g) +4H2O(g) ��H< 0
B��2CO2(g) + 6H2(g)  CH3OCH3(g)+3H2O(g) ��H< 0
CH3OCH3(g)+3H2O(g) ��H< 0

��ͼ����ϩ����ͬʱ���ڣ���ͬ�¶��µIJ��ʣ������460��ʱ��ϩ���ʽ��͵�ԭ������
A������M�Ļ��Խ��� B��A��Ӧ��ƽ�ⳣ�����
C�����ɼ��ѵ������� D��B��Ӧ�Ļ������
��5��Na2CO3��ҺҲͨ����������CO2�������£�H2CO3�ĵ�һ�����ڶ������볣���ֱ�ԼΪKa1=4��10-7 ��Ka2=5��10-11����0.5mol��L��1��Na2CO3��Һ��pH���� �������ǵڶ���ˮ���H2O�ĵ��룩
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ��һ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ��20ml1 mol/L NaNO3��Һ��NO3-���ʵ���Ũ����ȵ���
A��10ml 1mol/L Mg(NO3)2��Һ B��50ml 0.4mol/L Al(NO3)3��Һ
C��10ml 2mol/L AgNO3��Һ D��10ml 0.5mol/L Cu(NO3)2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͼ��ʾ��װ�ý���ʵ�飬��Ӧһ��ʱ���Ͽ�K�����Ҳ��ձ��м���0.1 molCuO��CuSO4��Һǡ�ûָ�����Ӧǰ��Ũ�Ⱥ�pH������˵���в���ȷ����( )
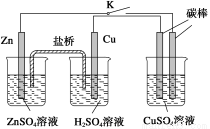
A��ͭ��Ϊ��������缫��ӦʽΪ2H����2e����H2��
B���ձ��Ҳ�̼��Ϊ��������缫�����к�ɫ��������
C����Ӧ������п������Ϊ13 g
D��������ͨ���ĵ��ӵ����ʵ���Ϊ0.2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ɹŸ�һ�ϵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
��ͼʵ��װ��������֤ijЩ���ʵ����ʡ����Թ�A��װ�������Ĺ���NaHCO3���Իش��������⣺
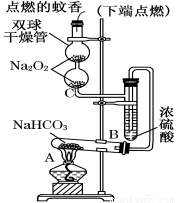
��1����A�Թ��ڷ�����Ӧ�Ļ�ѧ����ʽ��___________________��
��2��Bװ�õ�������_____________________��
��3����˫�������ڷ�����Ӧ�Ļ�ѧ����ʽΪ______________________��
��4��˫�������ڹ۲쵽��ʵ��������____________________________��
����ʵ������˵��____________________________��
��5������������ڵ�Na2O2����Na2O����˫�������ڹ۲쵽��ʵ��������_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ɹŸ�һ�ϵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������������Na2CO3��NaHCO3���ְ�ɫ�����ʵ������� ( )
A���ֱ������������ʵ���Һ�У�������������ʯ��ˮ
B���ֱ���������ֹ��壬�����ɵ�����ͨ�����ʯ��ˮ��
C���ֱ������������ʵ���Һ�У����������Ȼ�����Һ
D���ֱ������������ʵĵ�Ũ�ȵ���Һ�У�����������ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ��УЭ���������ѧ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��SO32-+I2+H2O=SO42-+2I��+2H+��ij��ɫ��Һ�п��ܺ�Na+��NH+ 4��Cu2+��K+��I����SO32-��SO42-���������������ʵ���Ũ����ȡ�����Һ�еμ�������ˮ����Һ����ɫ(�����������ˮ�⼰ˮ�ĵ���)�����й��ڸ���Һ���ж���ȷ����
A���϶�����I�� B������ȷ���Ƿ���SO42-
C�����ٺ���Na+��NH+ 4��K+�е����� D�����ܺ���Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ��УЭ���������ѧ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��2L�ĺ���������,����1molA��3molB������һ�������·������·�Ӧ��
A��s��+3B��g�� 2C��g��
2C��g��
����3s����C��Ũ��Ϊ0.6mol•L��1������ѡ��˵����ȷ�������
����A��ʾ�ķ�Ӧ����Ϊ0.1mol•L��1•s��1
����B��ʾ�ķ�Ӧ����Ϊ0.4mol•L��1•s��1
��3sʱ����C�����ʵ���Ϊ1.2 mol
��3sʱB��Ũ��Ϊ0.6mol•L��1
A���٢ڢ� B���٢ۢ� C���ۢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ��УЭ���������ѧ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
���������������������
A��ˮ B��һ����̼ C�������� D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ĸ߶��ϵ�һ���¿���ѧ���������棩 ���ͣ�ѡ����
��һ���ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A+B=2C (A��B��C��Ϊ����)������������A��B����4mol��A��ƽ����Ӧ����Ϊ0.12mol/L��s����10s�������е�B��
A��2.8mol  B��1.6mol C��3.2mol D��3.6mol
B��1.6mol C��3.2mol D��3.6mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com