
����Ŀ����������Ҫ�ĵ���,�Dz������Ļ�����Ʒ֮һ����ϳ�ԭ��Ϊ: N2(g)+3H2(g)2NH3(g)����H=-92.4 kJ��mol-1��
I�����ܱ������У�Ͷ��1mol N2��3 mol H2�ڴ��������·�����Ӧ��
(1)��÷�Ӧ�ų�������_____92.4kJ (����С������������������������)
(2)����ƽ����ϵ���¶�(�����������)����������ƽ����Է�������_____��(���������������С������������)
(3)���ﵽƽ��ʱ�����������������ѹǿ���䣬ƽ�⽫_______(����������������������������)�ƶ���
(4)���������ݡ����ȣ�����ʹ�������¶�Ѹ������ԭ����2����ƽ�⽫__________(���������ƶ������������ƶ����������ƶ���)���ﵽ��ƽ����������¶�______(��������������С��������������)ԭ����2����
II���÷�ӦN2(g)+3H2(g)2NH3(g) ��H=��92.4kJ/mol ��һ�ܱ������з�������ͼ��ijһʱ��η�Ӧ�����뷴Ӧ���̵Ĺ�ϵ����ͼ��
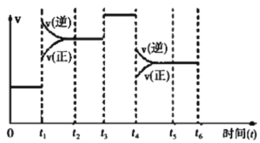
(1)t1��t3��t4ʱ�̣���ϵ�зֱ���ʲô���������˱仯��
t1__________��t3__________��t4__________��
(2)����ʱ����У����İٷֺ�����ߵ���_______
A��0��t1B��t2��t3 C��t3��t4D��t4��t5
���𰸡�С�� ��С ���� �����ƶ� С�� ���� ������� ��ѹ A
��������
I��(1)�����������ϳɰ��ķ�ӦΪ���淴Ӧ��1mol N2��3 mol H2��Ӧ���ɵ�NH3�����ʵ���С��2mol�����Էų�������С��92.4kJ��
(2)�÷�Ӧ�ʱ�С��0����������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ�����������ʵ������ӣ�����������������䣬����ƽ����Է���������С��
(3)����ѹǿ���������������뷴Ӧ������Ũ�ȼ�С���൱�ڼ�Сѹǿ���÷�Ӧ����ӦΪ����ϵ����С�ķ�Ӧ����Сѹǿƽ�������ƶ���
(4)�÷�Ӧ����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ��������¶�ʱƽ��������ƶ����ղ������������Դﵽ��ƽ����������¶�С��ԭ����2����
II��(1)t1ʱ�̸ı����������淴Ӧ���ʾ�˲��������ƽ�������ƶ����÷�ӦΪ���ȷ�Ӧ�����������¶ȿ���ʹ���淴Ӧ��������ͬʱƽ�������ƶ���
t3ʱ�̸ı����������淴Ӧ���ʾ�˲��������ƽ�ⲻ�ƶ�������ʱ�����˴�����
t4ʱ�̸ı����������淴Ӧ���ʾ�˲���С����ƽ�������ƶ����÷�ӦΪ������ٵķ�Ӧ���������������Сѹǿ����ʹ���淴Ӧ���ʼ�С��ͬʱƽ�������ƶ���
(2)��ͼ��֪t1��t2��t4��t5ʱ��ƽ��������ƶ������İٷֺ�����С��t3��t4ʱ��ƽ�ⲻ�ƶ�������t0��t1ʱ���ڰ��İٷֺ�����ߣ���ѡA��


 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ܱ������У�����һ�����¶ȷ������з�Ӧ��4A(g)��B(��)2C(g)��2D(g)������������������С����������������������������ա�
(1)��BΪ����ʱ������Ӧ���ҽ��У������ڻ��������ܶ�___________������Ӧ������У������ڻ��������ܶ�___________���������ڻ��������ܶȲ���ʱ___________˵����Ӧ�Ѿ��ﵽƽ�⡣
(2)��BΪ����ʱ���������ĸ�����Ӧ�������ڻ��������ܶ�___________���ʵ������ڻ��������ܶȲ���ʱ___________˵����Ӧ�Ѿ��ﵽƽ�⡣
(3)��BΪ����ʱ���������ĸ�����Ӧ�������ڻ�������ѹǿ___________���ʵ������ڻ�������ѹǿ����ʱ___________˵����Ӧ�Ѿ��ﵽƽ�⡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����32.0 gͭ��250 mLһ��Ũ�ȵ�����ǡ����ȫ��Ӧ��������NO��NO2��������ڱ�״���µ����Ϊ11.2 L�����ٶ���Ӧǰ����Һ������䣬Ҳ������N2O4�Ĵ��ڡ���
�Լ��㣺
��1����������ʵ���Ũ����____________ molL-1
��2����Ҫʹ�˻�����屻ˮ��ȫ���գ���Ҫͨ���״����__________L O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������п���Ʊ�ӫ��۵�ԭ��֮һ��ijʵ��������п�����̵��ң���Ҫ�ɷ�Ϊ��̿�ۡ�ZnO��PbO��FeO��SiO2)�Ʊ�𩷯(ZnSO4�� 7H2O)���������£�

��֪��ZnSO4������ˮ���������Ҵ�����ش��������}��
��1�����в�����������ȷ���� _________
A.������ϴ����ʱ����ϴҺ����ҺI�ϲ������������𩷯�IJ���
B.��ҺI�к����ϸߵ�������ZnSO4��PbSO4��FeSO4��H2SO4
C.�ؽᾧʱ���������ϡ��������Zn2+ˮ��
D. ��ϴ�Ӹ�����ʱ������95%�ľƾ���Ϊϴ�Ӽ�
��2����ͼ��װ����װ�ã�����һϵ�в�����ɳ��ˡ���ѡ����ʵı�ţ�����ȷ������˳��������
�ڲ���©���м�����ֽ��_____ ��_____��_______��________��ȷ�ϳ�ɡ�__________

��ת�ƹ�Һ�����ڿ���ˮ��ͷ���۹ر�ˮ��ͷ������ˮ��ͷ���ݼ�����������ˮ��ʪ��ֽ
��3��ijͬѧ�����һ��ʵ�鷽����֤������II�е�����Fe3+�������ھ���������Ѹ÷�������������_____ (����������ֱ����2��ϡ�����6��15%KSCN,________(������),֤������II�е����ʺ������ھ���I
��4��ijͬѧ��ȡ28.700g��ϸ��𩷯����(0.100mol), ���������г�ּ��ȡ���ȴ������,���־���ʧ��13.100g����ͬѧ������Ϊ���ڼ���ʧˮ�����л���������Ӧ���ø���Ӧ���ܵĻ�ѧ����ʽΪ_____________
��5�����̵������������{�����պ��ٰ��������̲�����𩷯������������ߣ���ԭ����________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)�ǹ����Ϲ��ϵİ�ȫ��������ɫ�������������¶�������Ϊ����ɫ���壬���۵�Ϊ��59.5�棬�е�Ϊ11.0�棬��������ˮ������ˮ��Ӧ�����¶ȹ��ߣ��������ȵ�ˮ��Һ���ܻᷢ����ը��ij�о���ѧϰС����������ͼ��ʾװ����ȡ���ռ�ClO2(���Ⱥͼг�װ�þ�ʡ��)��

��1����Բ����ƿ���ȷ���һ������KClO3�Ͳ���H2C2O4)��Ȼ���ټ���������ϡ���ᣬ��60~80��֮�䷴Ӧ����ClO2��CO2��һ�������Σ��÷�Ӧ�Ļ�ѧ����ʽΪ________��
��2��װ��A��ʹ���¶ȼƵ�Ŀ����____����Ӧ��ʼ���Թ۲쵽Բ����ƿ�ڵ�������_____��
��3��װ��B��������________��
��4��ʵ�������װ��D�е���Һ�������Na2CO3�⣬���������ʵ���֮��Ϊ1�U1�����������Σ�һ��ΪNaClO3����һ��Ϊ_______��
��5��ClO2�ܲ��ȶ������������ƣ�������ˮ���յõ�ClO2��Һ��Ϊ�ⶨ������Һ��ClO2�ĺ���������������ʵ�飺
����1����ȡClO2��Һ20mL��ϡ�ͳ�100mL��������ȡV1mL�������뵽��ƿ�У�
����2������������pH��2.0������������KI���壬����Ƭ�̣�
����3������ָʾ��X���� cmol��L��1Na2S2O3����Һ�ζ����յ㣬����Na2S2O3��ҺV2mL��
��֪��2ClO2+8H++10I��==5I2+2C1��+4H2O 2Na2S2O3+I2=Na2S4O6+2NaI
��ش�
������100mL����3�������Na2S2O3����Һʱ���õ��IJ����������ձ�����Ͳ������������ͷ�ι��⣬����Ҫ_______��(����������)
�ڲ���3�еζ��յ������Ϊ_______��
��ԭClO2��Һ��Ũ��Ϊ_______g��L��1(�ú���ĸ�Ĵ���ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ�������ʵ�ı�������ȷ����( )
A.��⾫��ͭ��������Ӧ��Cu2+ +2e=Cu
B.����ʱ��0.1mol/L��ˮ��pH=11.1��NH3��H2O![]() +OH
+OH
C.������ʹ��̪��Һ��죺CH3COONa+H2O=CH3COOH+NaOH
D.��Na��Cl�γ����Ӽ��Ĺ��̣�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ���еȻ��ý��������ϼ�Ϊ+2�ۺ�+3�ۣ�����CoC12������ˮ��ijУͬѧ���ʵ����ȡ��CH3COO��2Co�������ܣ�����֤��ֽ����ش��������⣺
��1����ͬѧ��Co2O3�����ᷴӦ�Ʊ�CoC124H2O����ʵ��װ�����£�

����ƿ�з�����Ӧ�����ӷ���ʽΪ______��
������ƿ�е���Һ��ȡ�����CoC124H2O�����辭���IJ���������Ũ����______��ϴ�ӡ�����ȡ�
��2����ͬѧ���ü�ͬѧ�Ƶõ�CoC124H2O�ڴ����Χ���Ƶ���ˮ��CH3COO��2Co������������װ�ü��飨CH3COO��2Co�ڵ��������еķֽ�����֪PdC12��Һ�ܱ�CO��ԭΪPd��

��װ��E��F�����ڼ���CO��CO2�ģ�����ʢ��PdC12��Һ����װ��______���E����F������
��װ��G��������______��E��F��G�е��Լ����������۲쵽I������ͭ��죬J�й����ɰ�ɫ����ɫ��K��ʯ��ˮ����ǣ���ɵó��Ľ�����______��
��ͨ������������______��
��ʵ�����ʱ����Ϩ��D��I���ľƾ��ƣ�һ��ʱ����ٹرյ��ɼУ���Ŀ����______��
�������������շֽ����ɹ�̬������X��CO��CO2��C2H6����n��X����n��CO����n��CO2����n��C2H6��=1��4��2��3�������еijɷֲ����뷴Ӧ�������������ڿ��������зֽ�Ļ�ѧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
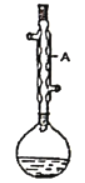
����Ŀ��ʵ���Һϳ����������IJ������£���Բ����ƿ�м�������Ҵ���Ũ�����4.5g�����ᣬ�ټ���2~3Ƭ���Ƭ����ʼ��������Բ����ƿ������50���ӡ�����ӦҺ�������º����Һ©���У�������ˮ������Na2CO3��Һ��ˮϴ�ӣ���Һ��IJ������������ˮ����þ���壬����Ƭ�̣����˳�ȥ����þ���塣�����������ռ�77~78����֣��õ�����������Ʒ5.28g��
(��֪���Ҵ������ᡢ���������ķе�������78.4����118����77.1��)
(1)����A��������________
(2)����ƿ�м����Ҵ���Ũ������Ⱥ�˳����_______
(3)��ϴ�Ӳ����У�Na2CO3��Һϴ�ӵ���ҪĿ����_______
(4)��ʵ���У�����������Ʒ�IJ���Ϊ_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������һ��ʹ�ù�̬����ʵ�ȼ�ϵ�أ���Ч�ʸ��ߣ������ں��캽�ա���ͼ1��ʾװ���У���ϡ������������Ϊ���Ե缫���ڵ缫�Ϸֱ�ͨ��CH4�Ϳ��������й�̬������Dz�����Y2O3��ZrO2���壬���ڸ������ܴ���O2��(O2��4e��=2O2��)��
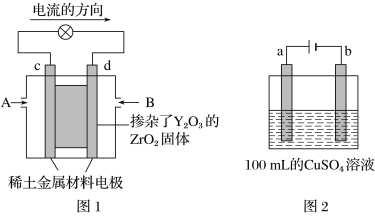
(1)c�缫������Ϊ________(��������������������)��d�缫�ϵĵ缫��ӦʽΪ�� ____��
(2)��ͼ2��ʾ�ö��Ե缫���100 mL 0.5 mol��L��1CuSO4��Һ��a�缫�ϵĵ缫��ӦʽΪ�� __________����a�缫����56 mL(��״��)���壬��������Һ��c(H��)=________(��������Һ����仯)����Ҫʹ�������Һ�ָ������ǰ��״̬���ɼ���________(����ĸ)��
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com