
【题目】燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。

(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:___________;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1。
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组om] | 温度℃ | 起始量/mol[ | 平衡量/mol | 达到平衡所需 时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K=________,该反应的ΔH________0 (填“>”或“<”)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则b/a 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V逆 V正(填“<” ,“>” ,“=”)。
④判断该反应达到平衡的依据是________。
A.CO2减少的化学反应速率和CO减少的化学反应速率相等 B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都相等 D.容器中气体的平均相对分子质量不随时间而变化
【答案】(1)SO2-2e-+2H2O=4H++SO42-
(2)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O ΔH=-(3/2b+2c-a-d)kJ·mol-1
(3) ①1/6(或0.17) ΔH<0 ② >1 ③ > ④ A
【解析】
试题分析:(1)SO2在负极失去电子转化为SO42-,故其电极反应为:SO2+2H2O-2e-=SO42-+4H+;
(2)已知:①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=--akJmol-1;
CH3OH(g)+H2O(g) △H=--akJmol-1;
②2H2(g)+O2(g)═2H2O(g) △H=--bkJmol-1;
③H2O(g)═H2O(l) △ H=--ckJmol-1;
④CH3OH(g)═CH3OH(l) △H=--dkJmol-1,
根据盖斯定律,将②×3/2+③×2-①-④得:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)
△H=3/2×△H2+2△H3-△H1-△H4=-(3/2b+2c-a-d)kJmol-1,所以CH3OH(l)燃烧热的热化学方程式为
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O ΔH=-(3/2b+2c-a-d)kJ·mol-1;
(3)①实验1中CO的转化率为![]() ×100%=40%,实验2中CO的转化率为
×100%=40%,实验2中CO的转化率为![]() ×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,实验2条件下平衡常数,需要列式计算平衡浓度;
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,实验2条件下平衡常数,需要列式计算平衡浓度;
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol/L) 0.5 1 0 0
转化浓度(mol/L) 0.2 0.2 0.2 0.2
平衡浓度(mol/L) 0.3 0.8 0.2 0.2
K=![]() =
=![]() =0.17;
=0.17;
②根据CO(g)+H2O(g)![]() CO2(g)+H2(g),增大水蒸气的浓度,平衡向正反应方向移动,CO的转化率增大,水蒸气的转化率减小,即a/b<1,则b/a>1;
CO2(g)+H2(g),增大水蒸气的浓度,平衡向正反应方向移动,CO的转化率增大,水蒸气的转化率减小,即a/b<1,则b/a>1;
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,Qc=1>K=0.17,反应向逆反应方向进行,即V正<V逆;
④A、CO2减少的化学反应速率和CO减少的化学反应速率相等,表示V正=V逆,能够判断反应达到了平衡,A正确;B、该反应为气体体积不变的反应,容器内气体压强始终保持不变,不能判断反应达到了平衡,B错误;C、CO、H2O、CO2、H2的浓度都相等,但不一定是不变的,则不能够判断反应达到了平衡,C错误;D、容器内气体的物质的量不变,气体的质量不变,容器中气体的平均相对分子质量始终不变,不能判断反应达到了平衡,D错误;答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是
A.利用废弃的秸秆可生产生物质燃料乙醇
B.燃煤中加入CaO可减少SO2气体的排放
C.浸泡过高锰酸钾溶液的硅藻土可保鲜水果
D.纤维素与淀粉互为同分异构体,在人体内都可转化为葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,可升华,易溶于热水,微溶于冷水,溶于乙醇。请你根据提供的信息回答下列问题:
(1)将装置中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置示意图中,仪器a的名称是 ,其作用是 。
(2)反应结束后加适量冷水,可分离出苯乙酸粗品。其加入冷水的目的是 ____ 。下列仪器中可用于分离苯乙酸粗品的是_______(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)如果要将苯乙酸粗品进一步提纯,你可以选择的实验方法是__________。(写出两种方法)
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的操作与现象是 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_________________。
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是_____________,1mol(C2H5O)3P=O分子中含有的σ键的数目为__________________。
(4)已知固态NH3、H2O、HF的氢键键能和结构如下:

解释H2O、HF、NH3沸点依次降低的原因___________________。
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有________个,与碳原子等距离最近的碳原子有__________个。已知碳化硅晶胞边长为apm,则晶胞图中1号硅原子和2号碳原子之间的距离为________pm,碳化硅的密度为__________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g) ![]() 2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min) ④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:

已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 / Mn(OH)3 |
开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
完全沉淀pH(c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是___________________________________;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=____________________。
(2)滤液1中加入H2O2的作用是________________________________________。
(3)写出滤液2中的Mn2+变成MnO2的离子方程式_______________________________。
(4)写出滤渣B与稀硫酸在pH=5时反应的化学方程式_____________________________。
(5)工艺中还可以将滤液4进行_____________、_____________、_____________、洗涤得到含结晶水的硫酸盐晶体。
(6)MnO2常用来制取KMnO4。在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液阳极电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极)。
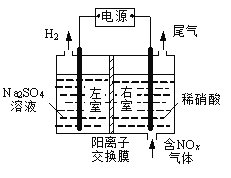
(1)若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式: 。
②若有标准状况下2.24 LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为 mol。
(2)某小组在右室装有10 L 0.2 mol/L硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。
①实验前,配制10 L 0.2mol/L硝酸溶液,需量取 mL的密度为1.4 g/mL、质量分数为63%的浓硝酸。
②电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 molHNO3、0.1 molHNO2,同时左室收集到标准状况下28 L H2。计算原气体中NO和NO2的体积比(假设尾气中不含氮氧化物,写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H为芳香酯,其合成路线如下图,A ~ G 均为芳香族化合物,B能发生银镜反应,D的相对分子质量比C大4,E的核磁共振氢谱有3组峰

①2RCH2CHO![]() R-
R-![]()
②![]()
![]()
![]()
请回答下列问题:
(1)A的名称是________,B含有的官能团的名称是________;
(2)A→B的反应类型为________,C→D的反应类型是________;
(3)B、E的结构简式分别为___________、___________;
(4)E→F与F→G的顺序能否颠倒_____(填“能”或“否”),理由_______;
(5)符合下列要求的A的同分异构体有多种,其中核磁共振氢谱为4组峰,且面积比为6:2:1:1_________;(写出其中一种的结构简式)。
①与Na反应并产生H2 ②芳香族化合物
(6)根据已有知识,结合相关信息,写出CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成流程图(无机试剂任选),合成流程示意图如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名丹麦物理学家尼·玻尔(N·Bohr)将他钟爱的金制诺贝尔奖章用王水溶解成“金溶液”,化学方程式可简单表示为:Au+HNO3+3HCl===AuCl3+NO↑+2H2O,AuCl3+HCl===HAuCl4(四氯合金酸)。纳粹分子对这种溶液“愚笨”得视而不见、毫无所知。战争结束后,物理学家又根据以下反应,炼出黄金并铸出更加灿烂夺目的奖章:2HAuCl4![]() 2HCl↑+3Cl2↑+2Au。表现出伟大科学家对祖国的无比热爱和非凡智慧。下列叙述中正确的是( )
2HCl↑+3Cl2↑+2Au。表现出伟大科学家对祖国的无比热爱和非凡智慧。下列叙述中正确的是( )
A.王水能溶解黄金,但不能溶解白金
B.HAuCl4具有很强的氧化性
C.盐酸有很强的还原性
D.浓盐酸和浓硝酸按照体积比1:3能配成王水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com