

 ,B
,B .D的含氧官能团的名称为酯基.
.D的含氧官能团的名称为酯基.
 ;
; .
.
 .
. 分析 (1)流程图非常简单,生成A,即为KMnO4氧化苯环上的甲基而生成羧基,A→C,结合D产物,显然为A与乙醇在浓硫酸作用下发生酯化反应,最后将硝基还原即等氨基;根据D的结构简式判断所含氧官能团名称;
(2)从C的结构简式看,硝基邻、间位上的H,亚甲基和甲基上的H,共四种不同的氢谱;与C具有相同官能团,而且苯环上只有两种不同化学环境氢原子,-NO2直接与苯环相连的同分异构体即满足要求的同分异构体必须有:取代在苯环的对位上,且含有酯基和硝基的结构;
(3)能与FeCl3发生显色反应的必须是酚,显然F可以水解生成酚羟基;
(4)D物质水解可生成对氨苯甲酸,含有氨基和羧基两种官能团,它们可以相互缩聚形成聚合物.
解答 解:(1)苯环上的甲基能被酸性高锰酸钾氧化为羧基,则A为

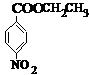
故答案为:

(2)根据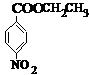
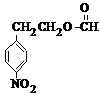
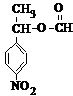
(3)能与FeCl3发生显色反应的必须是酚,显然F可以水解生成酚羟基,则在碱性条件下的反应为 ,生成的W与甲醛发生缩聚反应生成
,生成的W与甲醛发生缩聚反应生成 ,
,
故答案为: ;
; ;
;
(4)D物质水解可生成对氨苯甲酸,含有氨基和羧基两种官能团,它们可以相互缩聚形成多肽化合物和水,反应方程式为
 ,故答案为
,故答案为 .
.
点评 该题为传统的有机化学综合题.综合了有机物基团的转化、同分异构体、水解反应、缩聚反应等知识.核磁共振氢谱的分析体现了新课程的变化,中等难度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物 | |
| C. | 糖类、油脂、蛋白质都能发生水解反应 | |
| D. | 油脂有油和脂肪之分,都属于酯类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法.其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子.如C2H6离子化后可得到C2H6+、C2H5+、C2H4+…,然后测定其质荷比.某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法.其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子.如C2H6离子化后可得到C2H6+、C2H5+、C2H4+…,然后测定其质荷比.某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )| A. | 甲醇 | B. | 甲烷 | C. | 丙烷 | D. | 乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有强还原性,反应中放出大量的热 | |
| B. | 高温时在空气中能燃烧 | |
| C. | 具有良好的导热性 | |
| D. | 反应后生成熔点更高的氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)铅是碳的同族元素,比碳多4个电子层.铅在元素周期表的位置为第六周期.第ⅣA族;PbO2的酸性比CO2的酸性弱(填“强”或“弱”).
(1)铅是碳的同族元素,比碳多4个电子层.铅在元素周期表的位置为第六周期.第ⅣA族;PbO2的酸性比CO2的酸性弱(填“强”或“弱”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体单质中,一定有δ键,可能有π键 | |
| B. | δ键比π键重叠程度大,形成的共价键强 | |
| C. | 两个原子间形成共价键时,最多有一个δ键 | |
| D. | N2分子有一个δ键,两个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com