
下列离子或分子在溶液中能大量共存且满足相应要求的是 ( )
| 选项 | 离子或分子 | 要求 |
| A | K+、SO | c(K+)<c(SO |
| B | Fe3+、Na+、NO | 溶液pH=1 |
| C | Na+、Al3+、Cl-、SO | 滴加氨水立即有沉淀产生 |
| D | NH | 滴加NaOH溶液立即有气泡产生 |
科目:高中化学 来源: 题型:
废旧铅蓄电池的回收利用是发展循环经济的必经之路。其阴、阳极填充物(铅膏,主要含PbO、PbO2、PbSO4)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)、碳酸铅可用于合成三盐基硫酸铅(组成可表示为3PbO·PbSO4·H2O),其工艺流程如下:
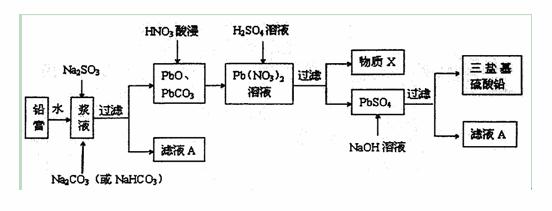
(1)用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,写出转化反应方程式:
(2)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有____________、___________、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是________ ____。
(3)物质X是一种可循环使用的物质,其溶质主要是______________(填化学式),若X中残留的 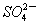 过多,循环利用时可能出现的问题是__________________。
过多,循环利用时可能出现的问题是__________________。
(4)生成三盐基硫酸铅的离子方程式为____________________。
(5)向铅膏浆液中加入Na2SO3溶液的目的是将其中的PbO2还原为PbO。若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15%,则要将PbO2全部还原,至少需要加入______mL的0.5 mol/LNa2SO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中只可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO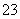 、⑥SO
、⑥SO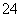 中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 | 操作 | 现象 |
| (1) | 用pH试纸检验 | 溶液的pH大于7 |
| (2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
下列结论正确的是 ( )
A.肯定含有的离子是③④⑤
B.肯定没有的离子是②⑤
C.可能含有的离子是①⑥
D.不能确定的离子是③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在水溶液中能大量共存的一组离子是 ( )
A.Na+、Ba2+、Cl-、NO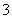
B.Pb2+、Hg2+、S2-、SO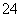
C.NH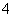 、H+、S2O
、H+、S2O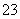 、PO
、PO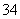
D.Ca2+、Al3+、Br-、CO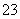
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液含有Ⅲ中的离子(见下表),欲用Ⅰ中的试剂来检验溶液中是否还含有Ⅱ中的离子,能够成功检验的是(说明:在实验过程中不允许进行加热、过滤、萃取等操作)( )
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 稀氨水 | Al3+ | Mg2+ |
| B | 稀硝酸、AgNO3溶液 | Cl- | I- |
| C | KSCN溶液 | Fe2+ | Fe3+ |
|
| 稀盐酸、BaCl2溶液 | SO | SO |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活密切相关,下列说法不正确的是:
A.乙烯可作水果的催熟剂
B.硅胶可作袋装食品的干燥剂
C.褔尔马林可作食品的保鲜剂
D.氢氧化铝可作胃酸的中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是
A.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是_____。
(2)XY2-离子的立体构型是_______;R2+的水合离子中,提供孤电子对的是原子是______。
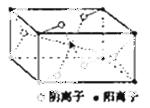
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数之比是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com