
【题目】根据如图所示实验装置,回答下列问题:
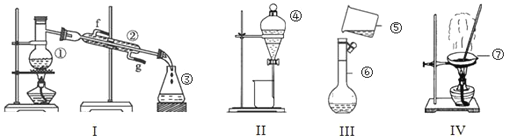
(1)写出下列仪器的名称:②_________,③_________,⑦__________。
(2)上述仪器中实验之前需检查装置是否会漏水的是______________(填仪器名称)。
(3)实验室准备用18mol/L浓硫酸配制100mL 3mol/L稀硫酸,则所需浓硫酸的体积是____mL(保留一位小数),量取浓硫酸所用量筒的规格是____(选填“10mL”、“25mL”或“50mL”)。在实验操作的摇匀过程中,不慎洒出几滴,此时应采取的措施是_______,若所配制的稀硫酸浓度偏大,则下列可能的原因分析中正确的是_______。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.定容时,俯视溶液的凹液面
【答案】冷凝管 锥形瓶蒸发皿分液漏斗、容量瓶16.7mL25mL重新配制BCD
【解析】
(1)根据仪器构造可知②是冷凝管,③是锥形瓶,⑦是蒸发皿;
(2)分液漏斗、容量瓶在使用之前需检查装置是否会漏水;
(3)根据稀释过程中溶质的物质的量不变可知用18mol/L浓硫酸配制100mL 3mol/L稀硫酸所需浓硫酸的体积是![]() ,因此量取浓硫酸所用量筒的规格是25mL;在实验操作的摇匀过程中,不慎洒出几滴,溶质减少,则此时应采取的措施是重新配制;A.配制前,容量瓶中有少量蒸馏水不影响,A错误;B.量取浓硫酸时,仰视液体的凹液面,浓硫酸的体积增加,浓度偏高,B正确;C.未冷却,立即转移至容量瓶定容,冷却后溶液体积减少,浓度偏高,C正确;D.定容时,俯视溶液的凹液面,溶液体积减少,浓度偏高,D正确。答案选BCD。
,因此量取浓硫酸所用量筒的规格是25mL;在实验操作的摇匀过程中,不慎洒出几滴,溶质减少,则此时应采取的措施是重新配制;A.配制前,容量瓶中有少量蒸馏水不影响,A错误;B.量取浓硫酸时,仰视液体的凹液面,浓硫酸的体积增加,浓度偏高,B正确;C.未冷却,立即转移至容量瓶定容,冷却后溶液体积减少,浓度偏高,C正确;D.定容时,俯视溶液的凹液面,溶液体积减少,浓度偏高,D正确。答案选BCD。


科目:高中化学 来源: 题型:
【题目】在过去,糖尿病的检测方法是把NaOH溶液和CuSO4溶液加入某病人的尿液中,微热时,如果观察到红色沉淀,说明该尿液中含有 ( )
A. 食醋 B. 白酒 C. 食盐 D. 葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子合物J的合成路线如下:

已知:i、
ii、
(1)写出E的名称:_____________,由G生成H的反应类型为:______________。
(2)I中官能团名称:____________________。B→C的反应条件为:___________。
(3)由I可合成有机物K,K中含有3个六元环,写出I合成K的化学方程式:____________________________________________________。
(4)D→E反应的化学方程式:_____________________________。
(5)有机物L(C9H10O3)符合下列条件的同分异构体有______种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基
(6)结合上述流程中的信息,设计由![]() 制备
制备 的合成路线_____。合成路线流程图示例:
的合成路线_____。合成路线流程图示例:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是

A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力大于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)与α(HA-)不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将22.4L HCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρ g/cm3(ρ>1),溶液的体积为V mL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w=![]() ×100% ②c=1molL﹣1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④所得溶液中含有NA个HCl分子.
×100% ②c=1molL﹣1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④所得溶液中含有NA个HCl分子.
A. 全部 B. ①③④ C. ①③ D. 只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列结构的物质:①CH3(CH2)3CH3
②CH3CH2CH2CH2CH3
③CH3CH2CH2CH2CH2CH3
④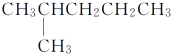
⑤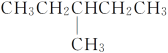
⑥
⑦
其中,属于同系物的是________;属于同分异构体的是__________;属于同种物质的是________。
A①② B②③ C③④⑤⑥⑦ D①③ E③④⑤⑦ F④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学利用注射器设计的简易实验装置。甲管中吸入10 mL CH4,同温同压下乙管中吸入50 mL Cl2,将乙管气体推入甲管中,将注射器用日光照射一段时间。
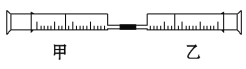
(1)下列是某同学预测的实验现象:
①气体最终变为无色;
②实验过程中,甲管活塞向内移动;
③甲管内壁有油珠;
④产生火花。
其中正确的是 。
(2)甲管中发生的化学反应类型为 。
(3)反应后,甲管中剩余气体最好用下列的 吸收。
A.水 B.氢氧化钠溶液
C.硝酸银溶液 D.饱和食盐水
(4)反应后,若将甲管中的物质推入盛有适量AgNO3溶液的小试管中会观察到 ,若用pH试纸测量甲管中溶液的酸碱性,可观察到pH试纸变 色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
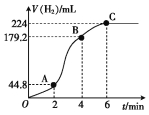
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着核电荷数的递增,氧化性逐渐减弱的一组是( )
A.I2、Br2、Cl2、F2B.F2、Cl2、Br2、I2C.F-、Cl-、Br-、I-D.Li、Na、K、Rb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com