
【题目】下表为某机物与对应试剂的反应现象或是否反应,则这种有机物可能是( )
试剂 | 钠 | 溴的四氯化碳溶液 | 新制 | 乙酸 |
现象或是否反应 | 放出气体 | 褪色 | 逐渐溶解 | 不反应 |
A.![]() B.
B.![]()
C.![]() D.
D.![]()
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
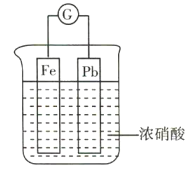
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯![]() 是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用
是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用![]() 和NO制备ClNO并测定其纯度。请回答:
和NO制备ClNO并测定其纯度。请回答:
I.甲组的同学拟制备原料气NO和![]() ,制备装置如下图所示:
,制备装置如下图所示:
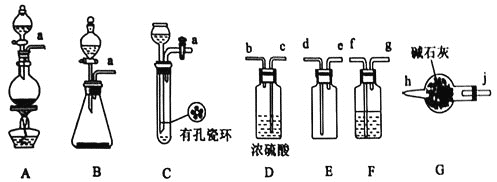
(1)若制备![]() 发生装置选B,则反应的离子方程式为_________________。若制备NO发生装置也选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为_______。
发生装置选B,则反应的离子方程式为_________________。若制备NO发生装置也选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为_______。
(2)欲收集一瓶干燥纯净的氯气,选择装置其连接顺序为:![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() 按气流方向,用小写字母表示
按气流方向,用小写字母表示![]() ,其中F装置的作用为________。
,其中F装置的作用为________。
II.乙组同学利用甲组制得的NO和![]() 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:
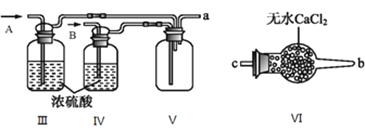
(3)为了使气体充分反应,从A处进入的气体是_______![]() 填
填![]() 或
或![]() 。
。
(4)装置Ⅲ、Ⅳ除可干燥NO、![]() 外,另一个作用是_________________。
外,另一个作用是_________________。
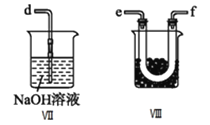
(5)装置Ⅷ的烧杯中盛放的试剂是______![]() 填编号:
填编号:![]() 水
水 ![]() 热水
热水 ![]() 冰水
冰水![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,实验室里用![]() 的盐酸溶液滴定
的盐酸溶液滴定![]() 氨水溶液,若用AG表示溶液的酸度,其表达式为:
氨水溶液,若用AG表示溶液的酸度,其表达式为: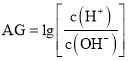 ,滴定曲线如图所示,下列说法正确的是
,滴定曲线如图所示,下列说法正确的是![]()
![]()
A.D点溶液中离子浓度关系为:![]()
B.C点加入盐酸的体积为10mL
C.若B点加入的盐酸溶液体积为5mL,所得溶液中:![]()
D.滴定过程中从A点到D点溶液中水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇能发生如下反应:
①![]() ;
;
②![]() ,
,![]() 。
。
由以上反应得出的结论错误的是( )
A.由反应①②可知,条件不同,乙醇与![]() 反应的产物不同
反应的产物不同
B.由反应②可知,![]() 是乙醇氧化生成乙醛的催化剂
是乙醇氧化生成乙醛的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键、碳氧键 、氢氧键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夏日的夜晚,常看到儿童手持荧光棒嬉戏,荧光棒发光原理是利用![]() 氧化草酸二酯(
氧化草酸二酯(![]() )产生能量,该能量被传递给荧光物质后发出荧光。草酸二酯的结构简式如图所示,下列有关草酸二酯的说法不正确的是( )
)产生能量,该能量被传递给荧光物质后发出荧光。草酸二酯的结构简式如图所示,下列有关草酸二酯的说法不正确的是( )
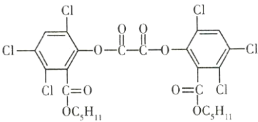
A.1mo草酸二酯与![]() 完全加成,需要消耗6mol
完全加成,需要消耗6mol![]()
B.草酸二酯的分子式为![]()
C.草酸二酯能发生取代反应
D.1mol草酸二酯最多可与4mol![]() 反应
反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种国际公认的安全、无毒的绿色消毒剂,沸点11℃,凝固点-59℃。工业上,可用下列原理制备ClO2(液相反应):![]() 。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
A.在标准状况下,2240mL ClO2含有原子数为0.3NA
B.若生成1.5mol Na2SO4,则反应后的溶液中Fe3+数目为0.2NA
C.48.0g FeS2完全反应,则上述反应中转移电子数为6NA
D.每消耗30mol NaClO3,生成的水中氢氧键数目为14NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是一种重要的战略资源,在半导体、航空航天测控等领域都有着广泛的应用。下图是以一种锗矿![]() 主要成分为
主要成分为![]() 、
、![]() 、
、![]() 为原料制备锗的工艺流程:
为原料制备锗的工艺流程:
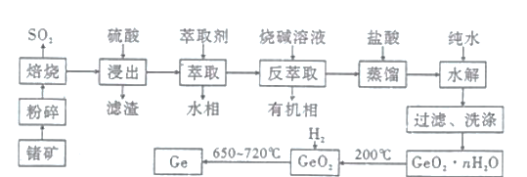
已知:
![]() 为两性氧化物。
为两性氧化物。
![]() “萃取”时用的萃取剂在本实验条件下对
“萃取”时用的萃取剂在本实验条件下对![]() 有很好的选择性。
有很好的选择性。
![]() 的熔、沸点分别为
的熔、沸点分别为![]() 、
、![]() ,极易水解放热。
,极易水解放热。
![]() “蒸馏”过程中发生的反应为
“蒸馏”过程中发生的反应为![]() 。
。
(1)锗在元素周期表中的位置为第_________周期第________族。
(2)“粉碎”的目的是_______________________。
(3)“焙烧”过程中![]() 发生反应的化学方程式为________________。
发生反应的化学方程式为________________。
(4)“滤渣”的成分为________________![]() 填化学式
填化学式![]() ,“水相”中的阳离子除了
,“水相”中的阳离子除了![]() 和
和![]() 外,还有__________________
外,还有__________________![]() 填离子符号
填离子符号![]() 。
。
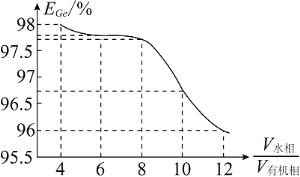
(5)“萃取”时,![]() 锗的萃取率
锗的萃取率![]() 与
与![]() 水相与有机相的体积比
水相与有机相的体积比![]() 的关系如图所示,从生产成本的角度考虑,最适宜的
的关系如图所示,从生产成本的角度考虑,最适宜的![]() 为______________
为______________![]() 填序号
填序号![]() 。
。
![]()
![]()
![]()
![]()
(6)“水解”时反应的化学方程式为_________________,该步实验操作必须在冰盐浴中进行的原因除了有利于水解反应正向进行外,还有______________。
(7)假设流程中每步都没有锗元素损失,若![]() 锗
锗 ![]() 含锗
含锗![]() 经提纯得到
经提纯得到![]() 的锗,则杂质元素的脱除率为_____________
的锗,则杂质元素的脱除率为_____________![]() 用含a、b、c的式子表示
用含a、b、c的式子表示![]() 。
。![]() 已知:杂质元素的脱除率
已知:杂质元素的脱除率![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com