

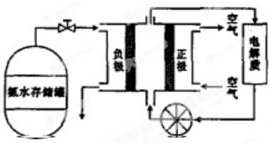
·ÖĪö £Ø1£©øł¾ŻĢāÖŠµÄĮ÷³ĢæÉÖŖ£¬·“Ó¦¢óŹĒĮņĖįøĘÓė½¹Ģ¼øßĪĀĢõ¼žĻĀ·“Ӧɜ³ÉĮņ»ÆøĘŗĶŅ»Ńõ»ÆĢ¼£»
£Ø2£©A£®ŅĄ¾ŻĮ÷³ĢĶ¼½įŗĻ·“Ӧɜ³ÉĪļ·ÖĪö£¬¹żĮæµÄæÕĘų°ŃŃĒĮņĖįøĘŃõ»ÆĪŖĮņĖįøĘ£»
B£®·“Ó¦¢ó»Æѧ·½³ĢŹ½ĪŖ£ŗCaSO4+4C=CaS+4CO”ü£¬ŹĒŃõ»Æ»¹Ō·“Ó¦£¬·“Ó¦¢ņĪŖ¶žŃõ»ÆĮņÓė°±Ė®µÄ·“Ó¦£¬ŹĒø“·Ö½ā·“Ó¦£»
C£®·ĄÖ¹Ģ¼ĖįĒāļ§ŌŚĪĀ¶Č¹żøߏ±·Ö½ā£»
D£®ĀČ»Æļ§ŹĒŅ»ÖÖµŖ·Ź£»
£Ø3£©£ØNH4 £©2SO3ÓėµŖŃõ»ÆĪļÉś³ÉµŖĘų£¬øł¾Żµē×ӵƏ§ŹŲŗćæÉÖŖ£¬Ķ¬Ź±Éś³ÉŅ»ÖÖµŖ·ŹÓ¦ĪŖĮņĖįļ§£¬¾Ż“ĖŹéŠ“»Æѧ·½³ĢŹ½£»
£Ø4£©¢Ł°±ĘųÓė¶žŃõ»ÆĮņ°“1£ŗ1·“Ӧɜ³ÉŃĒĮņĖįĒāļ§£¬°“2£ŗ1·“Ӧɜ³ÉŃĒĮņĖįļ§£¬¾Ż“ĖÅŠ¶Ļ£»
¢Śøł¾Żµē×ӵƏ§ŹŲŗćÓŠ¹ŲĻµŹ½5SO2”«2KMnO4£¬øł¾ŻSO2µÄĪļÖŹµÄĮæ¼ĘĖćKMnO4µÄĪļÖŹµÄĮ棬½ų¶ų¼ĘĖćc£ØKMnO4£©£»
£Ø5£©°±ĘųŹĒ¼īŠŌĘųĢå£»Éś³ÉµÄĪŽ¶¾ĘųĢåŹ±N2£¬¾Ż“ĖŹéŠ“»Æѧ·½³ĢŹ½£»øŗ¼«·¢Éś»¹Ō·“Ó¦£¬°±ĘųŌŚøŗ¼«·“Ó¦£¬×¢ŅāŹ±¼īŠŌ»·¾³£®
½ā“š ½ā£ŗ£Ø1£©øł¾ŻĢāÖŠµÄĮ÷³ĢæÉÖŖ£¬·“Ó¦¢óŹĒĮņĖįøĘÓė½¹Ģ¼øßĪĀĢõ¼žĻĀ·“Ӧɜ³ÉĮņ»ÆøĘŗĶŅ»Ńõ»ÆĢ¼£¬·“Ó¦·½³ĢŹ½ĪŖCaSO4+4C$\frac{\underline{\;øßĪĀ\;}}{\;}$CaS+4CO”ü£¬
¹Ź“š°øĪŖ£ŗCaSO4+4C$\frac{\underline{\;øßĪĀ\;}}{\;}$CaS+4CO”ü£»
£Ø2£©A£®¹żĮæµÄæÕĘų°ŃŃĒĮņĖįøĘŃõ»ÆĪŖĮņĖįøĘ£¬¹ŹAÕżČ·£»
B£®·“Ó¦¢ó»Æѧ·½³ĢŹ½ĪŖ£ŗCaSO4+4C=CaS+4CO”ü£¬ŹĒŃõ»Æ»¹Ō·“Ó¦£¬·“Ó¦¢ņĪŖ¶žŃõ»ÆĮņÓė°±Ė®µÄ·“Ó¦£¬ŹĒø“·Ö½ā·“Ó¦£¬ĖłŅŌ·“Ó¦ĄąŠĶ²»Ķ¬£¬¹ŹB“ķĪó£»
C£®·ĄÖ¹Ģ¼ĖįĒāļ§ŌŚĪĀ¶Č¹żøߏ±·Ö½āµĆ²»µ½ŠčŅŖµÄÄæ±ź²śĪļ£¬¹ŹCÕżČ·£»
D”¢ĀČ»Æļ§ŗ¬NŌŖĖŲ£¬ŹĒŅ»ÖÖµŖ·Ź£¬¹ŹDÕżČ·£»
¹Ź“š°øĪŖ£ŗACD£»
£Ø3£©£ØNH4 £©2SO3ÓėµŖŃõ»ÆĪļÉś³ÉµŖĘų£¬øł¾Żµē×ӵƏ§ŹŲŗćæÉÖŖ£¬Ķ¬Ź±Éś³ÉŅ»ÖÖµŖ·ŹÓ¦ĪŖĮņĖįļ§£¬ĖłŅŌ¶žŃõ»ÆµŖÓėŃĒĮņĖįļ§·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ4£ØNH4 £©2SO3+2NO2=N2+4£ØNH4 £©2SO4£¬
¹Ź“š°øĪŖ£ŗ4£ØNH4£©2SO3+2NO2=N2+4£ØNH4£©2SO4£»
£Ø4£©¢Ł°±ĘųÓė¶žŃõ»ÆĮņ°“1£ŗ1·“Ӧɜ³ÉNH4HSO3£¬°“2£ŗ1·“Ӧɜ³É£ØNH4£©2SO3£¬15.0mL2.0mol•L-1°±Ė®µÄĪļÖŹµÄĮæĪŖ0.03mol£¬±ź×¼×“æöĻĀ448mLSO2£¬SO2µÄĪļÖŹµÄĮæĪŖ0.02mol£¬ĖüĆĒµÄĪļÖŹµÄĮæÖ®±ČĪŖ3£ŗ2£¬½éÓŚ1£ŗ1Óė2£ŗ1Ö®¼ä£¬ĖłŅŌĪüŹÕŅŗÖŠµÄČÜÖŹĪŖNH4HSO3”¢£ØNH4£©2SO3£¬
¹Ź“š°øĪŖ£ŗNH4HSO3”¢£ØNH4£©2SO3£»
¢Śøł¾Żµē×ӵƏ§ŹŲŗćÓŠ¹ŲĻµŹ½5SO2”«2KMnO4£¬øł¾Ż¢ŁæÉÖŖSO2µÄĪļÖŹµÄĮæĪŖ0.02mol£¬ŌņKMnO4µÄĪļÖŹµÄĮæĪŖ$\frac{2}{5}$”Į0.02mol=0.008mol£¬ĖłŅŌc£ØKMnO4£©=$\frac{0.008mol}{0.025L}$=0.32mol/L£¬
¹Ź“š°øĪŖ£ŗ0.32mol/L£»
£Ø5£©°±ĘųŹĒ¼īŠŌĘųĢ壬ĖłŅŌµē½āŅŗ×īŗĆŃ”Ōń¼īŠŌµÄ£»Éś³ÉµÄĪŽ¶¾ĘųĢåŹ±N2£¬¾Ż“ĖŹéŠ“»Æѧ·½³ĢŹ½ĪŖ£ŗ4NH3+3O2=2N2+6H2O£¬øŗ¼«·¢Éś»¹Ō·“Ó¦£¬°±ĘųŌŚøŗ¼«·“Ó¦£¬×¢ŅāŹ±¼īŠŌ»·¾³£¬ĖłŅŌ£¬Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ2NH3-6e-+6OH-=N2+6H2O£¬
¹Ź“š°øĪŖ£ŗ¼īŠŌ£»4NH3+3O2=2N2+6H2O£»2NH3-6e-+6OH-=N2+6H2O£®
µćĘĄ ±¾Ģā漲鶞Ńõ»ÆĮņµÄŠŌÖŹ¼°ĪļÖŹµÄÖʱø£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕĻ°ĢāÖŠµÄŠÅĻ¢¼°·¢ÉśµÄ·“Ó¦ĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ¶žŃõ»ÆĮņµÄ»¹ŌŠŌµÄæ¼²éŗĶѧɜ·ÖĪöÄÜĮ¦µÄ漲飬ĢāÄæÄѶČÖŠµČ£®


 Õć“óÓÅѧŠ”ѧğ¼¶ĻĪ½Ó½Ż¾¶Õć½“óѧ³ö°ęÉēĻµĮŠ“š°ø
Õć“óÓÅѧŠ”ѧğ¼¶ĻĪ½Ó½Ż¾¶Õć½“óѧ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£®»šŅ©Ź¹ÓĆ | B£®ĮøŹ³Äš¾Ę | C£®»ī×ÖÓ”Ė¢ | D£®ŌģÖ½¼¼Źõ |
 |  |  |  |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na2O”¢Mn2O7”¢Fe2O3¾łĪŖ¼īŠŌŃõ»ÆĪļ | |
| B£® | ÉÕ¼ī²»ŹĒ¼ī”¢ŹÆĢæĖį²»ŹĒĖį”¢Ė«ŃõĖ®²»ŹĒĖ® | |
| C£® | µē½āÖŹŌŚĖ®ČÜŅŗÖŠµÄ·“Ó¦¶¼ŹĒĄė×Ó·“Ó¦ | |
| D£® | µ„ÖŹ¶¼ÓŠ»¹ŌŠŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČŻĘ÷ÄŚŃ¹Ēæ²»Ėꏱ¼äµÄŃÓ³¤¶ų±ä»Æ | |
| B£® | µ„Ī»Ź±¼äÄŚĆæĻūŗÄmøöA·Ö×ÓµÄĶ¬Ź±Ņ²Éś³ÉĮĖdøöD·Ö×Ó | |
| C£® | µ„Ī»Ź±¼äÄŚĆæÉś³ÉeøöC·Ö×ÓµÄĶ¬Ź±Ņ²Éś³ÉĮĖnøöB·Ö×Ó | |
| D£® | A”¢B”¢C”¢DĖÄÖÖĪļÖŹµÄ·Ö×ÓŹżÖ®±ČĪŖm£ŗn£ŗe£ŗd |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ¶žŃõ»ÆĮņ³£ÓĆ×÷Ļū¶¾¼ĮŗĶĘÆ°×¼Į£¬Ņ²ŹĒŅ»ÖÖÖŲŅŖµÄ¹¤ŅµŌĮĻ£®
¶žŃõ»ÆĮņ³£ÓĆ×÷Ļū¶¾¼ĮŗĶĘÆ°×¼Į£¬Ņ²ŹĒŅ»ÖÖÖŲŅŖµÄ¹¤ŅµŌĮĻ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 īę”¢øõ”¢īŃ”¢ÄųĖä²»ŹĒ֊ѧ½×¶Ī³£¼ūµÄ½šŹōŌŖĖŲ£¬µ«ŌŚ¹¤ŅµÉś²śÖŠÓŠ×ÅÖŲŅŖ×÷ÓĆ£®
īę”¢øõ”¢īŃ”¢ÄųĖä²»ŹĒ֊ѧ½×¶Ī³£¼ūµÄ½šŹōŌŖĖŲ£¬µ«ŌŚ¹¤ŅµÉś²śÖŠÓŠ×ÅÖŲŅŖ×÷ÓĆ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com