
| A. | NaOH溶液(Ba(OH)2):用K2SO4溶液 | B. | NaCl溶液(Na2SO4):用Ba(NO3)2溶液 | ||
| C. | KOH溶液K2CO3:用CaCl2溶液 | D. | HNO3溶液(HCl):用AgNO3溶液 |
分析 A.硫酸钾与氢氧化钡反应生成硫酸钡和KOH;
B.硫酸钠与硝酸钡反应生成硫酸钡沉淀和硝酸钠;
C.碳酸钾与氯化钙反应生成碳酸钙沉淀和KCl;
D.HCl与硝酸银反应生成AgCl沉淀和硝酸.
解答 解:A.硫酸钾与氢氧化钡反应生成硫酸钡和KOH,引入新杂质KOH,应选试剂为硫酸钠,故A错误;
B.硫酸钠与硝酸钡反应生成硫酸钡沉淀和硝酸钠,引入新杂质,应选试剂为氯化钡,故B错误;
C.碳酸钾与氯化钙反应生成碳酸钙沉淀和KCl,引入新杂质,应选试剂为氢氧化钙,故C错误;
D.HCl与硝酸银反应生成AgCl沉淀和硝酸,则用硝酸银可除杂,故D正确;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握发生的化学反应及除杂的原则为解答本题的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 途径①反应中体现了浓硝酸的强氧化性和酸性 | |
| B. | 途径②的第二步反应在实际生产中可以通过增大O2浓度来提高产率 | |
| C. | 由途径①和②分别制取1mol H2SO4,理论上各消耗1mol S,各转移6mol电子 | |
| D. | 途径②与途径①相比更能体现“绿色化学”理念,是因为途径②比途径①污染相对小且原子利用率高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+ | |
| B. | 含有大量Fe3+的溶液中:Al3+、SCN-、Br-、Na+ | |
| C. | 加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
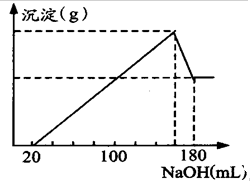 将一定质量的镁、铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液到过量,
将一定质量的镁、铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液到过量,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体是纯净物 | |
| B. | 胶体与溶液的本质区别是有丁达尔效应 | |
| C. | Al(OH)3胶体具有很强的吸附能力,能凝聚水中的悬浮物,也能吸附色素,可做净水剂 | |
| D. | 胶体粒子可以透过半透膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的H2SO4为0.2mol | B. | 参加反应的NaOH约为0.27mol | ||
| C. | 加入铝粉的质量为5.4g | D. | 与硫酸反应的铝粉的质量7.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| N2 | H2 | NH3 | |
| 投料Ⅰ | 1.0mol/L | 3.0mol/L | 0 |
| 投料Ⅱ | 0.5mol/L | 1.5mol/L | 1.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“△H”表示,△H=H(终态)-H(始态).
热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“△H”表示,△H=H(终态)-H(始态).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com