
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 Fe3O4+6SO2,有3mol FeS2参加反应,转移
mol电子。
Fe3O4+6SO2,有3mol FeS2参加反应,转移
mol电子。
(2)FeCl3溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3)与明矾相似,Fe2(SO4)3也可用作净水剂,在使用时发现Fe2(SO4)3并不能使酸性废水中的悬浮物沉降除去,其原因是 。
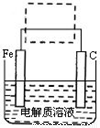
(4)钢铁的电化学腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框中作出修改,并用箭头标出电子流动的方向。
(1)32
(2)2Fe3++Cu=2Fe2++Cu2+ 铁粉、稀硫酸
(3)酸性废水抑制Fe3+ 的水解,使其不能生成有吸附作用的Fe(OH)3胶体
【解析】
试题分析:(1)反应中FeS2中铁与硫的化合价均升高,氧气化合价下降,可以根据化合价升高总数也可以根据化合价降低总数计算转移电子数,3mol FeS2参加反应,转移电子数为8×4=32mol;(2)从腐蚀液中回收铜应采用置换法,有足量铁置换,再用稀硫酸除去铜中的铁;(3)Fe2(SO4)3可用作净水剂,是源于其水解产生氢氧化铁胶体,但酸性废水抑制Fe3+ 的水解,使其不能生成有吸附作用的Fe(OH)3胶体,故不能除去悬浮物;(4)该图所示铁的电化学防腐应为采用外加电源的电化学防腐,铁应与电源的负极相连。
考点:考查化学原理中氧化还原反应、电化学、水解等有关问题。


 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 催化剂 |
| 高温高压 |
| ||
查看答案和解析>>
科目:高中化学 来源:2012届福建省泉州四校高三第二次联考化学试卷 题型:填空题
(12分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2  6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
(4)钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
查看答案和解析>>
科目:高中化学 来源:2010年沙河一中考前预测卷化学试题 题型:填空题
(12分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,转移
mol电子。
6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,转移
mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)
(4)①钢铁的电化腐蚀简单示意图如下,将该图稍作修改 即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。

②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式 。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com