
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法正确的是
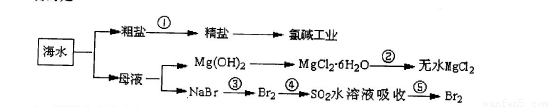
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序可以为碳酸钠溶液、NaOH溶液BaCl2溶液,过滤后加盐酸
B.第②步中结晶出的MgCl2·6H2O可在HCl气流中加热分解制无水MgCl2
C.在第③④⑤步中溴元素均被氧化
D.第⑤步涉及的分离操作有过滤、萃取、蒸馏
B
【解析】
试题分析:A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序可以为NaOH溶液、BaCl2溶液、碳酸钠溶液,过滤后加盐酸;也可以是BaCl2溶液、NaOH溶液、碳酸钠溶液,过滤后加盐酸。总之就是SO42-离子要在Ca2+之前除去,以使引入的过量的Ba2+与Ca2+一同用CO32-除去,减少实验步骤。错误。B.MgCl2是强碱弱酸盐,加热容易发生水解反应,HCl挥发逸出而得到Mg(OH)2,使产物不纯。实验第②步中结晶出的MgCl2·6H2O可在HCl气流中加热分解就可以抑制其水解来制无水MgCl2。正确。C.化合价升高,失去电子,被氧化;化合价降低,得到电子,被还原。在第③中Br化合价升高,被氧化;在④中发生反应:Br2+SO2+2H2O=H2SO4+2HBr。Br化合价降低,被还原。在⑤步中在HBr→Br2.化合价升高,被氧化。错误。D.第⑤步涉及的分离操作有蒸发、浓缩、蒸馏。错误。
考点:考查海水的综合利用中的除杂是顺序、混合物的分离、反应过程中的原理的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

| A、用澄清的石灰水可鉴NaHCO3和Na2CO3 | B、制取NaHCO3的反应是利用其溶解度小于NaCl的溶解度 | C、在第③、④、⑤步骤中,溴元素均被氧化 | D、工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
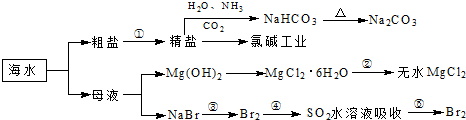
| A、过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | B、用澄清的石灰水可鉴别NaHCO3和Na2CO3 | C、过程②中结晶出的MgCl2?6H2O要在HCl氛围中加热脱水制得无水MgCl2 | D、工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com